随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol
开发新能源如太阳能和氢能是绿色化学对能源领域的贡献 #生活常识# #环保生活Tips# #绿色化学#
相关习题
0 21416 21424 21430 21434 21440 21442 21446 21452 21454 21460 21466 21470 21472 21476 21482 21484 21490 21494 21496 21500 21502 21506 21508 21510 21511 21512 21514 21515 21516 21518 21520 21524 21526 21530 21532 21536 21542 21544 21550 21554 21556 21560 21566 21572 21574 21580 21584 21586 21592 21596 21602 21610 203614
科目:来源:题型:
随着化石能源的减少,新能源的开发利用日益迫切.
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ?mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ?mol-1
2HI(g)=H2(g)+I2(g)△H=c kJ?mol-1
则:2H2O(g)=2H2(g)+O2(g)△H=
kJ?mol-1
(2)甲醇制氢有以下三个反应:
CH3OH(g)=CO(g)+2H2(g)△H=+90.8kJ?mol-1 Ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-43.5kJ?mol-1 Ⅱ
CH3OH(g)+O2(g)=CO2(g)+2H2(g)△H=-192.0kJ?mol-1 Ⅲ
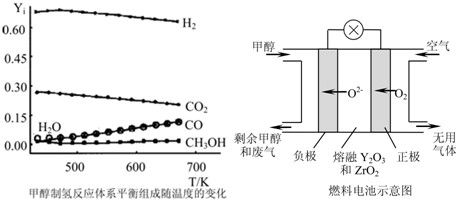
①当CH3OH(g)、O2(g)、H2O(g)总进料量为1mol时,且n(CH3OH):n(H2O):n(O2)=0.57:0.28:0.15,在0.1MPa、473~673K温度范围内,各组分的平衡组成随温度变化的关系曲线见图.(图中Yi表示各气体的体积分数,氧气的平衡浓度接近0,图中未标出).下列说法正确的是
.
A.在0.1MPa、473~673K温度范围内,甲醇有很高的转化率
B.温度升高有利于氢气的制备
C.寻找在较低温度下的催化剂在本制氢工艺中至关重要
②已知反应Ⅱ在T1℃时K=1,向恒容的密闭容器中同时充入1.0mol CO、3.0molH2O,达到平衡时CO的转化率为
.在反应达到平衡后再向其中加入1.0mol CO、1.0mol H2O、1.0mol CO2和1.0mol H2,此时该反应的v正
v逆(填“>”、“<”或“=”).
(3)一种以甲醇作燃料的电池示意图见图.写出该电池放电时负极的电极反应式:
.
(4)LiBH4有很高的燃烧热,可做火箭的燃料,写出其燃烧反应的化学方程式:
.
查看答案和解析>>
科目:来源:题型:
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义.
(1)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是
;
②由MgO可制成“镁--次氯酸盐”电池,其装置示意图如图1,该电池正极的电极反应式为
;
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH+H2O (g)△H=QkJ?mol-1
①该反应的平衡常数表达式为K=
.
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中发生上述反应,反应相同时间后测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q
0(填“>”“<”或“=”);
③在其中两个容器中,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为KⅠ
KⅡ(填“>”“<”或“=”).
(3)用H2或CO催化还原NO可以达到消除污染的目的.
已知:2NO(g)═N2(g)+O2(g)△H=-180.5kJ?mol-1
2H2O(1)═2H2(g)+O2(g)△H=+571.6kJ?mol-1
则2H2(g)与NO(g)反应生成N2(g)和H2O(1)的热化学方程式是
.
查看答案和解析>>
科目:来源:题型:
含硫化合物在工业生产中有广泛的用途.
(1)SO2可用于工业生产SO3.
①在一定条件下,每生成8gSO3 气体,放热9.83kJ.该反应的热化学方程式为
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2mol SO2和1mol O2.甲保持压强不变,乙保持容积不变,充分反应后均达到平衡.
Ⅰ.平衡时,两容器中SO3体积分数的关系为:甲
乙(填“>”、“<”或“=”).
Ⅱ.若乙在t1min时达到平衡,此时测得容器乙中的转SO2化率为90%,则该反应的平衡常数为
;保持温度不变t2min时,再向该容器中充入1molSO2 和1mol SO3,t3min时达到新平衡.请在图1中画出t2~t4min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆)
(2)硫酸镁晶体(MgSO4?7H2O)在制革、医药等 领域均有广泛用途.4.92g硫酸镁晶体受 热脱水过程的热重曲线(固体质量随温度 变化的曲线)如图2所示.
①固体M的化学式为
.
②硫酸镁晶体受热失去结晶水的过程分为
个阶段.
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为
.
查看答案和解析>>
科目:来源:题型:阅读理解
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.
I已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
CO(g)+O2=CO2(g)△H2=bkJ?mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
则C的燃烧热
kJ.mol-1
II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
(填序号).
A.C(s)+C02(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1)
C.2H20(l)=2H2(g)+02(g)
D.2C0(g)+02(g)=2C02(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
.
(2)某实验小组模拟工业合成氨反应N2+3H22NH3△H=-92.4kJ?mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应 前压强为P0,反应过程中压强用P表示,反应过程中与时间t的关系如图所示.请回答下列问题:
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为
③若提高N2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C)=0.2mol?L-1,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是
mol?L-1.
查看答案和解析>>
科目:来源:题型:
(1)一种新型锂电池是将化学式为Li4Ti5O12的物质作为电池的正极材料,在放电的过程中变为化学式为Li4Ti5O12的物质.
①Li4Ti5O12中Ti元素的化合价为
,锂电池的突出优点是
.
②该锂电池是一种二次电池,放电时的负极反应式为
,充电时的阳极反应式为
.
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
①TiCl4水解生成TiO2?xH2O的化学方程式为
.
②滴定终点的现象是
.
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol?L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为
.
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果
(填“偏大”、“偏小”或“无影响”)o
(3)已知:
Ti(s)+2Cl2(g)=TiCl4(l)△H=-804.2kJ?mol-1
2Na(s)+Cl2(g)=2NaCl(s)△H=-882.0kJ?mol-1
Na(s)=Na(l)△H=+2.6kJ?mol-1
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的△H=
KJ?mol-1.
查看答案和解析>>
科目:来源:题型:
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验.填写下列空白:
实验Ⅰ:制取次氯酸钠溶液.
用石墨做电极电解饱和氯化钠溶液制取次氯酸钠溶液,设计图1所示装置进行实验.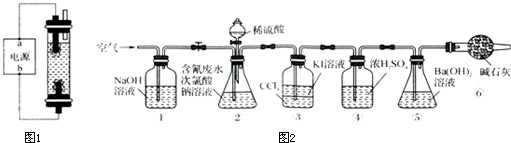
(1)电源中,a电极名称是
.
(2)反应时,生成次氯酸钠的离子方程式为
.
实验Ⅱ:测定含氰废水处理百分率.
利用所示装置(图2)进行实验.将CN-的浓度为0.200 0mol?L-1的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:CN-+ClO-═CNO-+Cl-,2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(3)①和⑥的作用是
.
(4)装置②中,生成需由装置③除去的物质的离子方程式为
.
(5)反应结束后,缓缓通入空气的目的是
.
(6)为计算该实验中含氰废水被处理的百分率,需要测定
的质量.
(7)上述实验完成后,为了回收装置③中的CCl4需要的操作是
.
(8)若要研究装置②中所加稀硫酸的最佳浓度,请设计利用该装置进行实验的记录表.
要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量;③可将提供的方框作为表的外边框使用.
查看答案和解析>>
科目:来源:题型:阅读理解
镍及其化合物与生产、生活密切相关.
(1)镍能与CO反应,生成的Ni(CO)4受热易分解,化学方程式为:Ni(s)+4CO(g)?Ni(CO)4(g)
①该反应的正反应为
(填“吸热”或“放热”)反应.
②吸烟时,烟草燃烧生成的CO会与烟草中微量的Ni在肺部发生该反应,生成容易进入血液的Ni(CO)4,使人重金属中毒.从化学平衡的角度分析,促使Ni(CO)4在血液中不断分解的原因是
.
③镍与CO反应会造成镍催化剂中毒.为防止镍催化剂中毒,工业上常用SO2除CO.已知: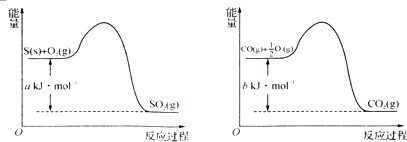
则用SO2除去CO的热化学方程式为
.
(2)为了研究镍制备过程中的各种因素对镍催化剂损耗的影响,选择制造镍催化剂的条件有:干燥方式为喷雾干燥、烘箱干燥,粒度大小为40μm和55μm,实验温度为60℃和80℃.设计下表实验,填写下列空白:
(Ⅱ)实验1和3制得的镍催化剂,用于探究制备的制备温度对镍催化剂损耗的影响
(Ⅲ) 2 3 4 60 55 烘箱干燥
(3)混合动力车通常使用碱性镍氢充放电池,其总反应式为:H2+2NiOOH2Ni(OH)2
①混合动力车在刹车或下坡时,电池处于充电状态,此时阳极的电极反应式
;
②镍氢电池材料(NiOOH)可在氢氧化钠溶液中用NaClO氧化NiSO4制得,该反应的化学方程式为
.
查看答案和解析>>
科目:来源:题型:
 锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).
锌锰干电池中含NH4Cl淀粉糊(电糊)、Mn02、炭粉和锌筒(含锌、铁和铜 等)等物质(如图).
(1)干电池中NH4Cl淀粉糊的作用是
(填“正极”、“负极”或“电解质”).
(2)干电池的负极反应式为
.
(3)回收废电池锌筒,进一步处理可得ZnSO4.7H20.其工业流程如下: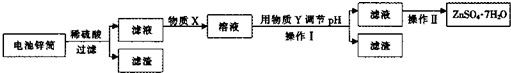
已知:
①物质X可以是
(填选项).
A?氯水 B.NaOH 溶液 C.KMnO4 溶液 D.H2O2 溶液 E O3
②在操作I前,需要调节pH的范围为
,物质Y是
③在制备ZnSO4-7H20的工艺中,操作n为
.
④某同学认为要得到ZnSO4JH2O,要在操作π前的滤液中加入稀H2S04.你认为有 必要吗?答:
(填“必要”或“不必要”),理由是
.
查看答案和解析>>
科目:来源:题型:阅读理解
 研究铁及铁的化合物的性质具有重要意义.
研究铁及铁的化合物的性质具有重要意义.
(1)如图(I)是为研究钢铁腐蚀部位与水中O2浓度的关系而设计的装置,该装置化学上称为差异充气电池.实验中观察到电流计指针偏转,B(Fe)极被腐蚀,则A(Fe)极的电极反应式为
.
(2)常温下,铁可在某些强氧化剂溶液中形成钝化膜而被保护.为探究钝化膜的成分,取一小段钝化后的铁片放入稀硫酸中加热,使铁片完全溶解.取1mL溶解液滴入3~5滴KmnO4溶液,观察到溶液紫色逐渐退去,则该反应的离子方程式是
;另取1mL溶解滴入3~5滴KSCN溶液,发现溶液不变色.能否由此推断钝化膜中不含+3价的铁?
(填“能”或“不能”),理由是
(用离子方程式表示).
(3)FeC13溶液与KI溶液混合,离子方程式为
.若要证明该反应为逆反应,某同学设计如下方法:
[方法1]取2mL0.1mol?L-1
溶液(填化学式)于试管中,然后加入0.5mL0.1mol?L-1
溶液(填化学式),充分振荡后,将混合液分成两份.一份加入
溶液(填化学式),若溶液变红色;另一份加入
溶液(填化学式),若溶液变蓝色,证明该反应为可逆反应.
[方法2]设计原电池装置如图(II),测得电流计指针偏转方向是电子的流动方向.开始观察到电流计指针向
(填“A”或“B”)集团,一段时间后,电流计指针不再偏转.此时若要证明电池反应达到平衡状态,可采取的方法及观察到的现象为
.
查看答案和解析>>
科目:来源:题型:
对工业合成氨条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I.N2(g)+3H2(g)?2NH3(g)△H=-90.0kJ/mol.II.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
(1)根据上述反应,写出表示H2燃烧热的热化学方程式
.
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如下图(图中所示数据均为初始物理量).
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解).
①该条件下甲容器中的K=
;平衡时,甲的压强P平=
(用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转换率=
.
(3)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如下图.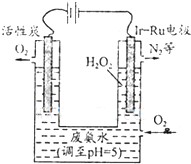
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
c(NO3-)(填“>”、“<”或“=”);
②Ir-Ru惰性电极有吸附O2作用,该电极的反应为
;
③理论上电路中每转移3mol电子,最多可以处理NH3?H2O的物质的量为
.
查看答案和解析>>
网址:随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol https://www.yuejiaxmz.com/news/view/201422
相关内容
甲烷作为一种新能源在化学领域应用广泛.请回答下列问题:(1)甲烷氢能是一种极具发展潜力的清洁能源.以太阳能为热源.热化学硫碘循环分解水是一种高效.无污染的制氢方法.其反应过程如图1所示:(1)反应Ⅰ的化学方程式是SO2+2H2O+I2=H2SO4+2HI.(2)反应Ⅰ得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层
(1)甲烷是一种高效清洁的新能源.0.25mol甲烷完全燃烧生成液态水时.放出222.5kJ热量.则甲烷燃烧热的热化学方为CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=
科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH
(1) SO2+I2+2H2O=H2SO4+2HI (2) 2H2SO4=2SO2+O2+2H2O (3) 2HI=H2+I2 ——青夏教育精英家教网——
近几年.大气污染越来越严重.雾霾天气对人们的生活.出行.身体健康产生许多不利的影响.汽车尾气是主要的大气污染源.降低汽车尾气危害的方法之一是在排气管上安装催化转化器.发生的反应为:则,△H= kJ(用含a.b.c.d的式子表示).(2)某温度下.向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示 题目和参考答案——青夏教育精英家教网——
随着环保意识增强.清洁能源越来越受到人们关注.(1)甲烷是一种理想的洁净燃料.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g),△H=
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
利用右图所示装置可吸收SO2.并用阴极排出的溶液吸收NO2.下列说法正确的是A.a为直流电源的负极B.阴极的电极反应式为:2HSO+2H++e
(14分)钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用资源。已知:①3Fe2O2(s)+CO(g)2Fe3O2(s)+CO2(g)△H=—47kJ/mol②Fe3O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=—

