甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=
在古典音乐中,有一种说法是‘音乐能治愈人心’,许多人在听巴赫的《G弦上的咏叹调》时会感到平静。 #生活乐趣# #日常生活趣事# #音乐欣赏的乐趣# #音乐趣闻轶事#
15. 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+12O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol
(1)甲醇蒸气完全燃烧的热化学方程式为CH3OH(g)+32O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol
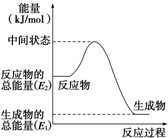
(2)反应②中的能量变化如图所示,则△H2=E1-E2kJ•mol-1
(3)H2(g)的燃烧热为285.9 kJ•mol-1.
分析 (1)②+①得CH3OH(g)+32O2(g)═CO2(g)+2H2O(l),依据盖斯定律计算反应热,写出热化学方程式;
(2)反应焓变△H=生成物总能量-反应物总能量,据此解答;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:(1)①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+12O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol;
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+32O2(g)═CO2(g)+2H2O△H2=-764.7kJ/mol;
故答案为:CH3OH(g)+32O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol;
(2)反应②中的能量变化如图所示,依据图象分析,反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2,
故答案为:E1-E2kJ•mol-1;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol,
故答案为:285.9 kJ•mol-1.
点评 本题考查了反应热的计算、热化学方程式的书写、燃烧热的概念,明确盖斯定律计算反应热的方法是解题关键,题目难度不大.
练习册系列答案
相关习题
科目:高中化学来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版)题型:选择题
实验室欲配制6.00 mol·L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸 ②150 mL 3.00 mol·L-1的硫酸 ③足量的18.00 mol·L-1的浓H2SO4。配制要求:①、②两种硫酸全部用完,不足部分由③补充。选用容量瓶的规格是( )
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
查看答案和解析>>
科目:高中化学来源:题型:选择题
6.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
A.平衡逆向移动了B.物质A的转化率减小了C.物质B的质量分数增大了D.反应速率增大,且v正>v逆查看答案和解析>>
科目:高中化学来源:题型:解答题
3. 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为c(CO)c(H2)c(H2O).
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
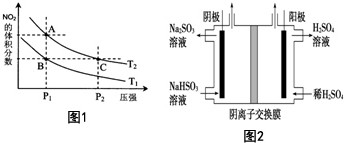
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图1所示.下列说法正确的是E:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用图2装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,阳极区逸出气体的成分为O2、SO2(填化学式).
查看答案和解析>>
科目:高中化学来源:题型:选择题
10.下列分子只表示一种物质的是( )
A.C3H7ClB.C3H8C.C4H10D.C2H6O查看答案和解析>>
科目:高中化学来源:题型:选择题
20.化学与生活、生产、环境等密切相关,下列说法正确的是( )
①在饲料中加入“瘦肉精”,人食用猪肉后能降低“高血脂”的发病率;
②自备购物袋,不用塑料方便袋;
③建立空调凝结水和屋面雨水收集系统,充分利用水资源;
④大力发展、推广可利用太阳能、风能的城市照明系统;
⑤可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大;
⑥用填埋法处理未经分类的生活垃圾;
⑦明矾可以用来净水,是利用明矾水解生成Al(OH)3胶体,从而起到杀菌消毒功效;
⑧Mg可由电解熔融的MgCl2制取,Al也可由电解熔融AlCl3制取.
查看答案和解析>>
科目:高中化学来源:题型:解答题
7.矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源.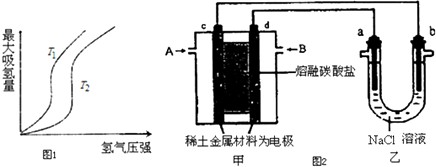
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 (M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是bd;
a.T1>T2 b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动 d.上述反应可实现多次储存和释放氢气
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL.
①工作过程中,甲装置中d电极上的电极反应式是O2+4e-+CO2=CO32-;乙装置中电极a为阳极(填电极名称).
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=13.(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2KJ/mol;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:N2(g)+3H2(g)?高温高压催化剂2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%.
①该反应的平衡常数表达式为:K=c2(NH3)c(N2)c3(H2);
②能判断该反应是否达到化学平衡状态的依据是a
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2):c(H2):c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的d
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气 d、增加H2的浓度 e、充入He,使体系总压强增大.
查看答案和解析>>
科目:高中化学来源:题型:选择题
4.下列说法正确的是( )
A.温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态B.已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJC.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1D.已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定查看答案和解析>>
网址:甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1= https://www.yuejiaxmz.com/news/view/201425
相关内容
(8分)甲醇是人们开发和利用的一种新能源。已知:①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8kJ/mol;②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9kJ/mol。(1)甲醇蒸气完全燃烧的热C和H2在生产、生活、科技中是重要的燃料.①2C(s)+O2(g)═2CO(g)△H1=
(1)甲烷是一种高效清洁的新能源.0.25mol甲烷完全燃烧生成液态水时.放出222.5kJ热量.则甲烷燃烧热的热化学方为CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol
甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g)CH3OH(g)ΔH1反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2①上述反应
日常生活、生产中甲烷既是重要的清洁能源也是一种重要的化工原料.(1)如图1是CH4/H2O体系放氢焓变示意图:则CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
随着环保意识增强.清洁能源越来越受到人们关注.(1)甲烷是一种理想的洁净燃料.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g),△H=
甲烷作为一种新能源在化学领域应用广泛.请回答下列问题:(1)甲烷
含氮化合物对人类生活有十分重大的意义.(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.已知:N2(g)+O2△H=+180.5kJ/mol4NH3(g)+5O2+6H2O(g)△H=

