铁和铁的化合物在工业生产和日常生活中都有广泛的用途.(1)在定向爆破中.常利用氧化铁与铝反应放出的热量来切割钢筋.该反应的化学方程式为__.(2)已知:2Fe2O3=3CO2 △H=+468.2 kJ·mol
常见的金属元素有铁、铜、铝,广泛应用于建筑和工业生产中。 #生活百科# #百科知识#
(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
(1)Fe2O3+2AlAl2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
(3)①酸式 ②溶液恰好变浅紫红色,且半分钟内不褪色 ③0.080 00 mol·L-1
(4)①3.5 ②SO2
练习册系列答案
相关习题
科目:高中化学来源:不详题型:填空题
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。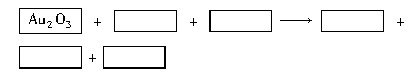
(2)反应中,被还原的元素是
,还原剂是
。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为
。
查看答案和解析>>
科目:高中化学来源:不详题型:实验题
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有
。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。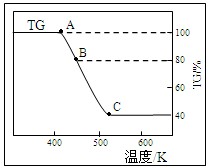
①试确定B点对应固体物质的化学式
;
②写出BC对应的化学方程式
。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用
滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为
。
(3)在步骤②中,下列操作会引起测定结果偏高的是
。
A.滴定管在盛装高锰酸钾前未润洗B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出C.滴定前读数正确,滴定终点时俯视读数D.滴定前读数正确,滴定终点时仰视读数(4)0.20g 样品中 FeC2O4的质量分数为
。(不考虑步骤②中的损耗)
查看答案和解析>>
科目:高中化学来源:不详题型:实验题
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有
。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:
; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
现象与结论
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡
若溶液颜色明显改变,且有 生成,则证明有铁单质存在
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色
步骤3:取步骤2得到的少量固体于试管中,滴加
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2+3Mn+24H+5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1=" 18.90" mL,V2="6.20" mL。根据数据计算0.20 g样品中:n(Fe2+)=
; n(C2)=
;FeC2O4的质量分数为
(精确到0.01%)。
查看答案和解析>>
科目:高中化学来源:不详题型:单选题
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合溶液。已知某200 mL的1 mol/L硫酸溶液中含有0.6 mol/L NaNO3,理论上最多溶解Cu的质量是( )
A.19.2 gB.11.52 gC.5.76 gD.9.6 g查看答案和解析>>
科目:高中化学来源:不详题型:填空题
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)=3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):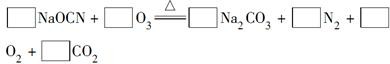
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学来源:不详题型:单选题
2011年11月,“神舟八号”在酒泉发射升空,并取得圆满成功。“神舟八号”的运载火箭所用燃料是偏二甲肼(C2H8N2)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应:提供能量。下列有关叙述正确的是( )
A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染B.该反应中N2O4是氧化剂,偏二甲肼是还原剂C.N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物D.每有0.6 mol N2生成,转移电子数目为2.4NA查看答案和解析>>
科目:高中化学来源:不详题型:单选题
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH2 K2S + K2SO3 + 3 H2O
若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。则以下正确的是
查看答案和解析>>
网址:铁和铁的化合物在工业生产和日常生活中都有广泛的用途.(1)在定向爆破中.常利用氧化铁与铝反应放出的热量来切割钢筋.该反应的化学方程式为__.(2)已知:2Fe2O3=3CO2 △H=+468.2 kJ·mol https://www.yuejiaxmz.com/news/view/352261
相关内容
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:(1)铁元素在周期表中的位置是 .(2)写出Fe与稀硫酸反应的离子方程式 .(3)已知:Fe2O3(s)+C(s)=CO2,△H=+234.1kJ/molC(s)+O2(g)=CO2(g); △H=(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:(1)铁元素在周期表中的位置是。(2)写出Fe与稀硫酸反应的离子方程式。(3)已知:Fe2O3(s)+C(s)=CO
铁是生产生活中应用最广泛的金属.炼铁技术备受关注.已知:①2Fe2O3+3CO2(g)△H=+460.5kJ•mol
铁及其化合物在日常生活.生产中应用广泛.氯化铁和高铁酸钾都是常见的水处理剂.如图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程.请回答下列问题:(1)已知:①Fe2O3+3CO(g)△H=+489.0kJ•mol
金属单质及其化合物与工农业生产.日常生活有密切的联系.请回答下列问题:(1)一定温度下.氧化铁可以与一氧化碳发生如下反应:Fe2O3+3CO2(g).△H=QkJ?mol
金属在日常生活中应用广泛.(1)用锌片和硫酸铜溶液的反应可呈现“铁树开花 的美景.该反应的化学方程式是 .(2)铁制品在喷漆前需放入稀盐酸中除锈.除铁锈的化学方程式是 . Zn + CuSO4 === ZnSO4 + Cu Fe2O3 + 6HCl === 2FeCl3 + 3H2O [解析] (1)锌和硫酸铜反应生成硫酸锌和铜.反应的化学方程式是Zn + 题目和参考答案——青夏教育精英家教网——
金属铝广泛应用于现代生产和日常生活中。 已知:4Al(s)+3O2(g)=2Al2O3(s)
生活处处有化学.我们学过的化学知识运用在生活中.会给我们的生活带来许多便利.比如:(1)我们知道.铁的菜刀会生锈.是因为它于空气中的水和氧气产生了反应.该反应化学方程式为4Fe+3O2+xH2O=2Fe2O3•xH2O.所以我们用不锈钢来代替.不锈钢属于铁合金的一种(2)生活中.我们的自来水通过过滤的方法来去除水中的固体物质.我们 题目和参考答案——青夏教育精英家教网——
铜及其化合物在工业生产和日常生活中有着广泛的应用。(1)Li
工业上常用CO还原氧化铁来冶炼生铁.请你一起参与以下探究:(1)该反应的化学方程式为aCO+Fe2O3bFe+3CO2.其中a= .b= .(2)已知一氧化碳是一种剧毒.难溶于水.密度比空气略小的气体.实验室收集一氧化碳时.常用排水法而不用排空气法.其主要原因是 .若想用右图所示装置收集一氧化碳.则气体应从 端通入瓶中.(3)由于一氧化 题目和参考答案——青夏教育精英家教网——

