【论肿道麻】Nature Review治疗耐药性:癌症靶向治疗适应性反应创造的机会
恶性肿瘤患者应遵医嘱进行规范治疗,包括手术、化疗和靶向治疗 #生活知识# #科技生活# #健康生活技巧# #恶性肿瘤#
正常细胞会探索多种状态,以在发育和自我更新过程中遇到的压力如饥饿、DNA损伤、毒素或感染中生存。癌细胞选择正常的压力缓解途径,在伴随肿瘤开始、进展、转移和免疫逃避的压力下生存。癌症治疗会加重癌细胞的压力,并启动快速的非基因组压力缓解过程,以保持细胞活力,因此代表了关键的靶向耐药机制。美国匹兹堡大学Ioannis Zervantonakis教授课题组在国际知名期刊Nat Rev Cancer发表题为《Therapy resistance: opportunities created by adaptive responses to targeted therapies in cancer》的综述,回顾了与肿瘤异质性相关的挑战,优先考虑可操作的适应性反应以获得最佳治疗效果,并制定了一个框架,以识别和针对因适应性反应和参与压力缓解途径而产生的细胞脆弱性。最后,讨论了在多个尺度上监测适应性反应的必要性,以及将旨在利用适应性反应和压力缓解途径的联合疗法应用于临床的必要性。现介绍如下:

1.前言
在这篇文章中,我们描述了肿瘤生态系统(包括癌细胞、免疫细胞和基质)适应治疗压力的机制,并描述了利用压力缓解过程的三种不同方法:第一,阻断压力缓解以诱导细胞死亡;第二,增加压力诱导细胞突变;第三,利用癌细胞和肿瘤微环境细胞中出现的脆弱点。
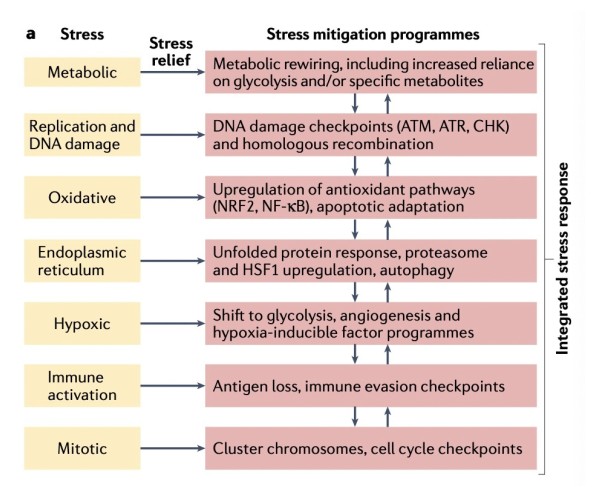
图1a 适应性反应创造的治疗机会
癌细胞以及肿瘤微环境(TME)中的细胞受到与肿瘤起始、进展、转移和免疫逃避等相关细胞状态改变所造成的压力。为了生存和适应这些压力源,癌细胞会利用内源性压力缓解途径(SMPs),这些途径已经进化到使正常细胞能够处理在发育和更新过程中发生的压力,或由于环境扰动(如饥饿、DNA损伤、膳食毒素、感染或癌症治疗)引起的压力。图1a显示了肿瘤开始、进展和转移期间癌细胞受到的压力的例子,癌细胞以及TME中的细胞也必须迅速实施额外的缓解策略(图1),以在癌症治疗产生的压力中生存下来。放疗、化疗和靶向治疗,以及免疫治疗,增加了持续的致癌压力,导致对SMPs的进一步依赖。癌细胞和肿瘤生态系统协同选择内源性SMPs的能力,包括维持组织稳态的异型细胞-细胞信号,构成了治疗耐药性的关键靶向机制。
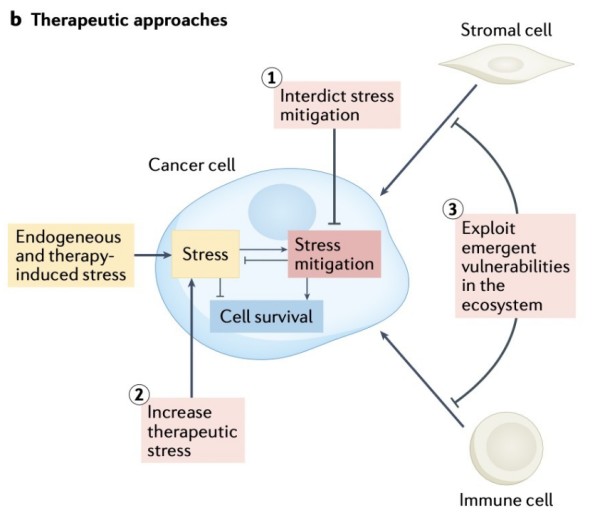
图1b 适应治疗应激和肿瘤生态系统(肿瘤、基质细胞和免疫细胞)中应激缓解途径的参与提供了三种治疗选择
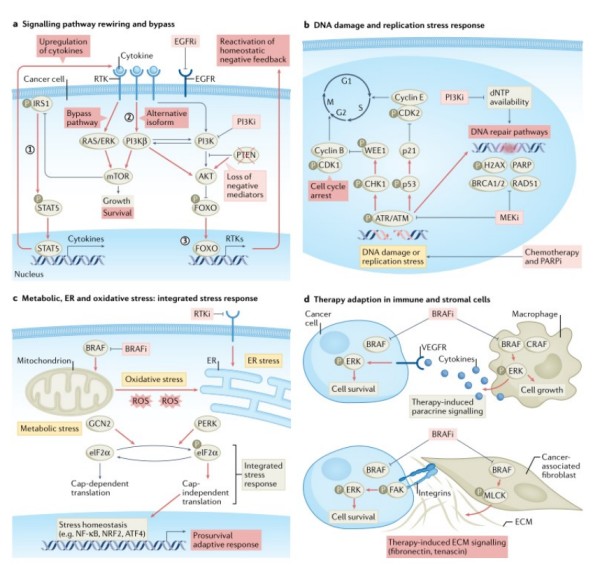
图2 癌细胞和肿瘤生态系统中的适应性反应程序
这里我们讨论了利用压力缓解过程的三种不同方法::一是阻断压力缓解诱导细胞死亡;二是增加压力诱导细胞突变;三是利用癌细胞和TME细胞中出现的脆弱性 (图2 )。
肿瘤固有的适应性反应方案
DNA损伤与复制压力
许多化疗和靶向药物通过消耗dNTPs或诱导DNA损伤(包括导致聚合酶停滞的交联和加合物)来增加复制压力(RS)。诱导复制分叉倒塌和随后的DNA双链断裂的药物,如聚(ADP核糖)聚合酶(PARP)抑制剂(PARPi),导致S和G2细胞周期DNA损伤检查点的激活,从而在进入M期之前通过同源重组等修复途径发生压力溶解(S期检查点)或损伤修复(G2期检查点)。未解决的RS导致磷酸化复制蛋白A (RPA)的缺失,这是主要的单链DNA结合蛋白,进一步积累DNA双链断裂以及微核和细胞质中的双链DNA。胞质DNA可导致STING通路的激活,从而产生干扰素诱导和先天和适应性免疫系统的参与。
代谢、氧化和内质网应激
在正常细胞中,代谢可塑性允许细胞在营养有限的条件下快速适应能量和代谢物的需求。氧化磷酸化(OXPHOS)是生长缓慢或干细胞的能量来源。糖酵解是高度增殖细胞首选的能量来源。在糖酵解和OXPHOS之间切换的能力是由主要调控因子控制的,如AMP活化蛋白激酶(AMPK)和HIF1,它们充当扰动传感器。许多不同的癌症治疗诱导代谢应激,包括PI3K通路抑制剂(可降低葡萄糖和氨基酸的摄取)或BRAF抑制剂(可影响糖酵解)。例如,依赖糖酵解的BRAF突变黑色素瘤细胞对BRAF抑制剂vemurafenib更敏感,而耐药细胞通过黑色素瘤细胞主调控因子MITF上调线粒体生物发生协同激活剂PGC1α,导致线粒体呼吸增加,对治疗的适应性抵抗和对OXPHOS抑制的敏感性。黑色素瘤细胞对BRAF抑制的细胞适应依赖于激酶GCN2,这是一种感知氨基酸水平的eIF2α激酶。
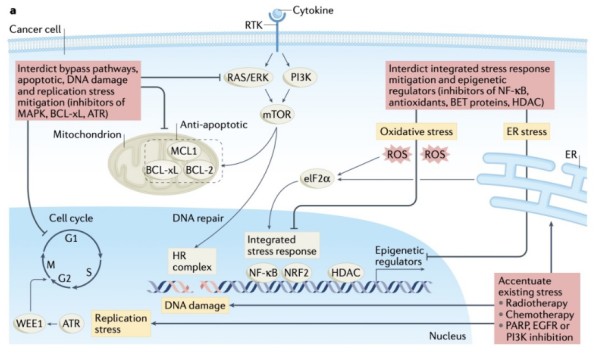
图3a 诱导癌细胞死亡的策略。
a.聚(ADP核糖)聚合酶(PARP)抑制剂(PARPi)诱导DNA损伤和复制应激,导致细胞周期停滞和DNA修复途径的参与。该图显示了涉及联合疗法的策略,以提高PARP抑制的效力,通过放疗或化疗增加压力。此外,有多种方法可以通过(1)阻断抗凋亡生存蛋白如BCL-xL(2)抑制DNA修复的上游介质(RAS/ERK抑制)或细胞周期检查点(ATR)(3)阻断表观遗传重编程组蛋白脱乙酰酶(HDACs)/溴结构域和末端外结构域(BET)蛋白,以及(4)应激缓解方案(例如,抗氧化剂NRF2和NF-κB)。
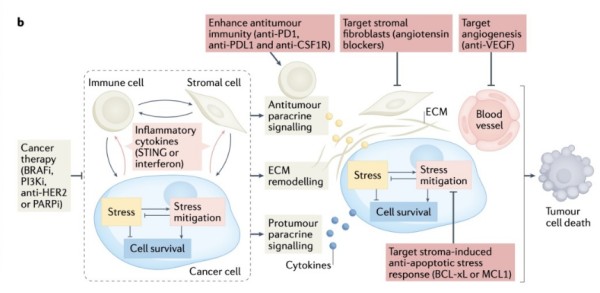
图3b 瞄准肿瘤生态系统中的机会是开发合理联合疗法的另一种方法
抗治疗肿瘤生态系统中的癌细胞可通过以下方式被靶向:(1)抑制免疫检查点以增强通过肿瘤免疫细胞旁分泌信号介导的抗肿瘤免疫;(2)阻断治疗诱导的细胞外基质(ECM)重塑以增强细胞毒性免疫细胞的募集,(3)靶向通过基质衍生细胞因子和ECM重塑诱导的抗凋亡信号,以及(4)阻断血管生成以使血管正常化并增强免疫细胞募集。
氧化应激: 癌细胞经常表现出高氧化应激,这是由于内部和外部代谢应激以及细胞抗氧化水平降低导致活性氧(ROS)和活性氮(RNS)的不平衡生成和消除造成的。此外,异常的癌细胞代谢可增加ROS和RNS水平。大多数化疗药(例如,蒽环类药物、铂配位复合物和拓扑异构酶抑制剂)和许多改变营养摄取和OXPHOS(例如,EGFR、BRAF和HER2抑制剂)的靶向治疗通过改变线粒体电子传输和降低抗氧化系统水平(如谷胱甘肽、过氧化物酶和超氧化物歧化酶)增加ROS和/或RNS水平。两个作用最广泛的ROS缓解方案受NRF2和NF-κB的调节;这些转录因子诱导作为ROS清除剂的基因表达,并防止与高ROS水平相关的凋亡。
内质网压力:内质网(ER)应激反应是由多种应激源触发的,如缺氧、代谢应激或蛋白质错误折叠。虽然内质网应激反应的强烈激活可以导致细胞死亡,但适度的活动可以起到保护作用。因此,内质网应激反应可以支持癌细胞的生存和治疗抵抗。例如,RTK靶向治疗子宫内膜癌和肾癌激活PERK驱动的内质网应激反应程序,导致自噬和NF-κ B信号SMPs的激活,从而促进细胞生存。
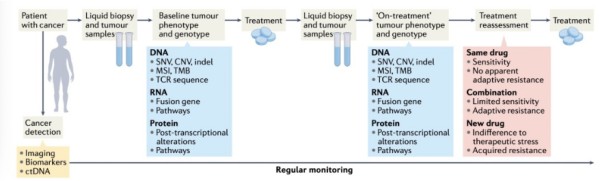
图4 实时提供个性化组合疗法的潜在方法
“综合应激应对”计划: 到目前为止描述的许多应激反应途径都会进入eIF2α磷酸化的激酶(例如PERK和GCN2)。eIF2α磷酸化可促进eIF2-eIF2B抑制复合物的形成,从而抑制整个帽依赖性翻译,同时促进调控的mRNA亚群的帽独立翻译。总之,这些eIF2α激酶整合来自许多不同压力的信号,从而诱导一套共同的压力缓解方案,称为“综合压力应对”。治疗诱导的应激可以压倒癌细胞的综合细胞应激反应,从而导致细胞死亡。此外,从帽依赖性到帽非依赖性蛋白质翻译的转换可以揭示新的治疗机会,如靶向凋亡通路。虽然本综述侧重于一些独立的应激途径和缓解过程,但重要的是要认识到,在许多情况下,它们汇聚在作为最终下游效应器的综合压力途径上。
肿瘤基质细胞的适应性反应
对治疗的适应性反应也可以通过肿瘤-宿主相互作用来介导,肿瘤生态系统中的细胞类型产生信号,使癌细胞中的SMPs参与其中。此外,治疗诱导的肿瘤生态系统的改变可以使基质细胞重新编程为促肿瘤或抗肿瘤表型。耐药性可由相邻的TME释放的大量生长因子和细胞因子维持,这些TME由脂肪细胞、癌症相关的成纤维细胞(CAFs)、免疫细胞和内皮细胞组成。重要的是,治疗诱导的肿瘤-宿主相互作用的改变可以重新激活信号通路并建立紧急治疗机会。
免疫组织: 治疗诱导的肿瘤生态系统的改变可以创造额外的脆弱点,也可以利用这些脆弱点来提高治疗效果。为了介导免疫逃避,肿瘤产生可溶性因子,在TME中编程先天和适应性免疫细胞,允许肿瘤进展。例如,在黑色素瘤小鼠模型中,BRAF抑制可招募巨噬细胞并将其重新编程为促肿瘤M2表型,并增加巨噬细胞衍生的VEGF分泌,进而重新激活黑色素瘤细胞中的ERK,导致治疗耐药性。此外,旨在抑制癌细胞生存的靶向治疗也可以直接影响免疫细胞功能。在小鼠模型中,多RTK抑制剂索拉非尼损害树突状细胞功能和抗原特异性T细胞的诱导,而MEK抑制可增加CD8+ T细胞的抗肿瘤活性。因此,针对癌细胞的治疗可通过多种不同机制影响免疫群体组成,加剧肿瘤支持免疫机制或者诱导抗肿瘤免疫反应。然而,可以明确的是靶向信号通路对免疫细胞表型和功能结果的影响是微妙的,需要在模型系统和临床试验中进一步探索,以开发出将多种类型的免疫细胞从免疫回避微环境转移到免疫抑制微环境的方法。因此,有必要对接受治疗的患者样本的完整肿瘤生态系统中的治疗诱导适应性进行进一步研究,以获得有效的临床转化。
CAFs和细胞外基质: 与正常的成纤维细胞相比,CAFs释放出高水平的促炎细胞因子和生长因子。TME细胞可受与癌细胞旁分泌和旁分泌相互作用的影响。例如,与不同肿瘤类型相关的CAFs经历不同的状态变化。在患者和共培养模型中,研究表明CAFs的分泌因子可以反过来影响状态,包括信号通路的重新激活,从而限制激酶抑制剂在多种实体肿瘤中的有效性。这些途径可以通过细胞毒性和靶向治疗来调节。BRAF抑制剂处理的CAFs驱动的细胞外基质重构,促进黑色素瘤小鼠模型中的细胞存活。此外,细胞-细胞外基质相互作用可以通过适应性反应介导对PI3K–mTOR靶向和HER2靶向治疗的耐药性,该适应性反应涉及卵巢癌和乳腺癌类器官和小鼠模型中抗凋亡BCL-2家族信号的上调。
利用适应性反应的策略
由肿瘤生态系统参与的肿瘤内在治疗压力和压力缓解过程提供了三种独立的治疗策略,以增加癌症治疗的疗效:(1)阻断SMPs,允许癌细胞在持续的压力下存活,从而诱导死亡;(2)加重现有的压力,从而压倒缓解策略,导致压力诱发的灾难;(3)利用肿瘤生态系统中的出现的脆弱性。
阻断SMPs以防止癌细胞存活: 通过阻断旁路通路或抑制同一家族中的冗余激酶成员,可以靶向由适应性信号重组产生的细胞存活。例如,在临床前研究中,使用PI3Kα/β抑制剂阻断多个PI3K家族成员与多种治疗联合可提高抗肿瘤疗效。通过抑制负反馈环激活的RTK,可以靶向涉及PI3K-AKT和RAS-MAPK信号轴的旁路通路。例如,使用mTOR抑制剂处理的乳腺癌细胞中AKT的再激活可以使用IGF1R抑制剂来阻断。为了对抗RTK适应性反应的异质性和冗余性,可以通过抑制下游激酶来靶向通路的再激活。阻断多个RTK下游的局灶性粘附激酶,在体外用HER2靶向药物治疗乳腺癌和用BRAF抑制剂治疗黑色素瘤小鼠模型后,可以有效地诱导癌细胞凋亡。RAS-MAPK治疗诱导PI3K-AKT-mTOR SMP在胰腺癌、黑色素瘤中的激活,使用AKT和mTOR抑制剂在体内和体外均可预防。这些实例提供了证据,即靶标的协同抑制以及用作缓解策略的适应性反应可以防止旁路并将适应性反应介导的细胞存活转化为细胞死亡
阻断与DNA损伤或RS相关的应激反应。
如前所述,治疗诱导的DNA损伤和RS、SMPs作为提高药物疗效的靶点。例如,由于PARPi参与S和G2 DNA损伤应激缓解检查点,PARPi结合抑制ATR-CHK1-WEE1级联,负责激活S期和G2损伤检查点,在卵巢癌和肺癌模型中通过有丝分裂突变和体内肿瘤消退诱导协同细胞死亡。许多研究(尽管存在争议)表明,ATR-CHK1-WEE1级联抑制剂在缺乏p53的细胞中更活跃,因为它增加了对S期和G2损伤检查点的依赖。除了参与DNA损伤检查点,PARP抑制可以通过RAS-MAPK通路激活增加同源重组修复能力,可以使用MEK抑制剂阻断该通路,使细胞对PARPi的影响敏感。PARPi与ATR-CHK1 、WEE1或MEK抑制剂联合已被转化到临床试验中,具有良好的早期活性。重要的是,PARPi有效治疗的最佳组合伙伴取决于每个肿瘤中激活的DNA修复通路。
阻止代谢压力应对计划
还描述了几种不同的靶向代谢适应疗法的方法,例如,通过协调抑制磷酸戊糖分流和谷氨酰胺水解来增加治疗诱导的代谢应激,以限制抗氧化介质的生成,并使细胞对产生的ROS敏感。与许多其他靶点一样,降低或增加ROS水平的影响可能很复杂,因为ROS不仅对肿瘤生存能力有影响,而且还可以影响转移潜能和免疫活性。此外,用CDK4和CDK6双抑制剂治疗乳腺和结直肠细胞系会导致癌细胞的代谢重编程,从而转向利用谷氨酸作为一种能源,可以通过靶向谷氨酰胺酶来开发。虽然很明显,适应代谢应激是肿瘤细胞和正常细胞都使用的一种缓解策略,但目前还没有简单的临床适用方法来确定和针对个别肿瘤中不同细胞群参与的缓解过程。
阻断氧化应激缓解计划。
抗氧化应激缓解方案的有效靶向抑制剂的开发在特异性、药效学、有效性和安全性方面提出了挑战。然而,抑制NRF2和NF-κ b的靶点,如硫氧还蛋白生成酶或谷胱甘肽生成酶,可增加药物敏感性。例如,PARPi诱导的氧化应激水平升高,有助于诱导DNA损伤和细胞死亡,能否通过抑制抗氧化酶硫氧还蛋白还原酶来诱导小鼠前列腺癌移植瘤的消退,需要进一步的工作来制定最佳的抗氧化剂量策略和交付,以避免毒性作用,并制定癌症患者的治疗指数。
持续性和治疗性应激增加
如上所述,癌症细胞持续的治疗诱导的压力会导致压力缓解方案的参与。如果压力增加到足以压倒压力缓解计划的程度,最终会导致癌细胞死亡。与正常细胞不同的是,癌细胞受到持续的压力,利用这种差异的压力水平的组合疗法可以提供一个足够的治疗指数。研究表明,正常细胞比癌细胞表现出更低的压力基线水平。为了解释与正常细胞相比,癌细胞对许多应激诱导疗法的敏感性增加,有人提出,当细胞超过共同的应激阈值时,应激诱导的灾难就会发生。这在RS或凋亡等情况下尤其明显,在这些情况下,突变或细胞死亡发生在压力阈值以上。几种方法已被用于增加RS或抑制缓解RS影响的途径。在PARPi的使用中加入吉西他滨或PI3K抑制剂可以通过消耗dNTPs显著增加RS,从而超载RS缓解途径,导致DNA损伤、S期和有丝分裂突变的积累,以及肿瘤生长抑制。放射治疗联合PARPi治疗可诱导DNA损伤反应通路和DNA损伤检查点缓解策略过载,导致DNA双链断裂数量增加,细胞凋亡,减慢尤文氏肉瘤模型中的肿瘤生长。一项正在进行的临床试验(NCT0419773) 正在测试癌症细胞中的持续RS和正常细胞中的低RS可能导致治疗指数的概念。
加剧上述代谢、内质网和氧化应激途径也可以压倒缓解途径,并通过凋亡或其他细胞死亡机制(如坏死、铁死亡和自噬性细胞死亡)导致细胞死亡。例如,EGFR抑制也被证明会增加内质网应激,并与PDK1抑制剂结合,将内质网应激增加到超出缓解途径的水平,导致肺癌异种移植的细胞死亡和生存率增加。因此,有效增加癌细胞中治疗诱导的压力水平的联合疗法提供了一种有希望的策略,通过诱导压力过载来阻止细胞生存,而压力过载可以压倒压力缓解过程,这种方法可能对治疗有效。
临床转化
肿瘤和肿瘤生态系统处于持续压力下的概念是将三种拟议方法(图1b)转化为临床适应性反应和由此产生的缓解过程的理论基础。与经验的联合治疗设计相比,这一概念为合理选择药物对和治疗反应的生物标志物提供了一个框架。要将这些机会转化为临床并为患者带来后续益处,需要部署一套复杂的组合疗法,能够(1)通过阻断压力缓解来靶向临床中的适应性反应,导致细胞死亡,(2)增加癌细胞的压力,导致细胞死亡,或(3)通过针对肿瘤生态系统中肿瘤或基质细胞的联合疗法,利用细胞探索不同状态和缓解策略时发生的网络重组。重要的是,能够利用这些替代品的药物组合明显不同,需要以适当的方式(可能采用不同的计划和给药策略)和最可能受益的患者进行部署(图4)。
总结
对肿瘤患者来说,癌症治疗抵抗仍然是一个主要挑战。为了改善患者的预后,我们需要进一步了解肿瘤生态系统在持续和治疗诱导的压力下生存的机制。单独分析肿瘤、间质和免疫细胞状态异质性的单细胞RNA测序或单细胞蛋白质组学方法将有助于发现新的治疗机会。鉴于对免疫疗法联合疗法的高度关注,对完整肿瘤生态系统的剖析也将促进对TME对治疗诱导压力的适应性理解。联合疗法对癌细胞内在状态的疗效需要与其对免疫系统的潜在有害影响相平衡。重要的是,压力、SMPs和靶向尝试的影响可能比本文所述的更细微,并且需要对潜在机制进行更深入的分析,更重要的是在临床和模型系统中以时间和空间分辨率分析扰动对癌症、基质和免疫细胞状态的影响。事实上,虽然本综述侧重于使用实例来阐明关键概念,但治疗靶向的效果可能取决于特定的肿瘤背景和治疗历史,也取决于完整的肿瘤生态系统。此外,SMPs的复杂网络以及不同组织和不同个体中不同SMPs的使用,以及在个体肿瘤中启动多种不同缓解途径的可能性,将需要详细分析患者样本,特别是接受治疗的患者样本中治疗对SMPs的影响。
尽管存在挑战,但靶向适应性反应和SMPs的机会不仅提供了直接影响癌细胞存活的潜力,而且还提供了防止基因组突变驱动的耐药克隆出现的潜力,这些克隆众所周知难以靶向,同时也提供了有效的免疫反应。因此,利用压力和SMPs有可能为癌症患者提供更多益处。
编译:符奕青,翁梅琳
审校:张军,缪长虹
参考文献:
Labrie M, Brugge JS, Mills GB, Zervantonakis IK. Therapy resistance: opportunities created by adaptive responses to targeted therapies in cancer. Nat Rev Cancer. 2022;22(6):323-339. doi:10.1038/s41568-022-00454-5
声明:古麻今醉公众号为舒医汇旗下,古麻今醉公众号所发表内容之知识产权为舒医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
网址:【论肿道麻】Nature Review治疗耐药性:癌症靶向治疗适应性反应创造的机会 https://www.yuejiaxmz.com/news/view/661585
相关内容
治疗癌症针灸有功!针灸治肿瘤第一人来答疑面对治疗的压力,癌细胞也学会了“解压”。
靶向治疗期间 牢记饮食运动6个法则
【论肿道麻】Nature Communications: 昼夜节律对衰老和长寿的重要性
当AI遇到癌症疗法,“癌症=感冒”不是梦!
直肠癌放射治疗,应用与误区全解析
mRNA疗法:肿瘤免疫治疗的新曙光?
Nature子刊:食物过敏的新疗法
中国癌症相关性疲乏临床实践诊疗指南(2021年版)
Nature Medicine|中南大学吴芳教授团队报道情绪压力与肺癌免疫治疗疗效的关系

