.(2)氧化剂与还原剂的物质的量之比是 .(3)若产生标况下22.4 L Cl2.则转 题目和参考答案——青夏教育精英家教网——
教育是实现生活质量飞跃的催化剂 #生活乐趣# #生活质量# #生活质量改善# #良好教育#
【题目】二氧化氯消毒剂是国际上公认的含氯消毒剂中唯一的高效消毒灭菌剂,实验室中KClO3和浓盐酸在一定温度下反应会生成二氧化氯,其变化可表述为:
2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________。
(2)氧化剂与还原剂的物质的量之比是________________。
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm—3,为使用方便,请计算出该浓盐酸中HCI的物质的量浓度________________mol·L—l。
试题答案在线课程【答案】 1:1 2 11.9
【解析】该反应中KClO3中氯元素化合价由+5得一个电子变成+4价,HCl中氯元素由-1价失一个电子变成0价,转移电子数是2,(1)用单线桥法可表示为:
;
(2)KClO3中氯元素化合价降低为氧化剂,HCl中氯元素化合价升高生成氯气部分为还原剂,另有一半化合价不变生成氯化钾做为酸的作用,故氧化剂和还原剂的物质的量之比是2:2=1:1;
(3)由反应可知,产生标况下22.4 L Cl2时,即1mol Cl2,转移2mol电子;
(4)质量分数为36.5%,密度为1.19 g·cm—3的浓盐酸,根据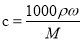 计算:
计算:
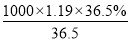 =11.9mol。
=11.9mol。
练习册系列答案
相关习题
科目:高中化学来源:题型:
【题目】 aAm+和bBn﹣核外电子层结构相同,则a值为( )
A.b+n﹣m
B.b﹣m﹣n
C.b+n+m
D.b﹣n+m
查看答案和解析>>
科目:高中化学来源:题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3 的混合液,经测定ClO-与ClO的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A. 21∶5 B. 11∶3 C. 3∶1 D. 4∶1
查看答案和解析>>
科目:高中化学来源:题型:
【题目】下列变化中必须加入氧化剂才能实现的是
A.MnO4—→Mn2+
B.KClO3→O2
C.HCl→Cl2
D.Fe3+→Fe2+
查看答案和解析>>
科目:高中化学来源:题型:
【题目】在下列反应中,属于氧化还原反应,且水既不作氧化剂又不作还原剂的是
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学来源:题型:
【题目】若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- AlO2-
C.K+ Na+ Cl- NO3- D.K+ NH4+ SO42- NO3-
查看答案和解析>>
科目:高中化学来源:题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子
COS(g)
H2(g)
CO(g)
H2S(g)
H2O(g)
CO2(g)
能量/ kJ·mol-1
1319
442
x
678
-930
1606
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
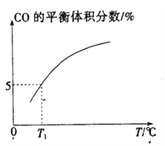
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学来源:题型:
【题目】下表列出了周期表中前20号元素中的十种元素的相关数据:
元素编号
元素性质
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
原子半径(10-10m)
1.52
2.27
0.74
1.43
0.77
1.10
0.99
1.86
0.75
0.71
最高价态
+1
+1
—
+3
+4
+5
+7
+1
+5
—
最低价态
—
—
-2
—
-4
-3
-1
—
-3
-1
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是________(填元素编号),其最高价氧化物的水化物的电子式为___________;与H2最容易化合的非金属单质是________(写物质名称)。
(2)写出元素③形成的一种具有强氧化性的氢化物的结构式______________。
(3)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式______________;⑤的最高价氧化物的电子式为__________。
(4)短周期另一元素Q的原子半径为1.02×10-10m,则该元素在周期表中位于________________。
(5)写出④的最高价氧化物的水化物与⑦的最高价氧化物的水化物反应的离子方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学来源:题型:
【题目】绿茶中含有的EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的一种衍生物A如图所示。有关衍生物A说法不正确的是( )
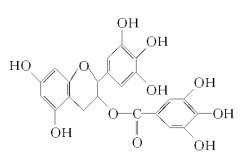
A.A在空气中易氧化,遇FeCl3溶液能发生显色反应
B.A能与碳酸氢钠溶液反应放出二氧化碳
C.1 mol A最多可与含9 mol氢氧化钠的溶液完全作用
D.1 mol A与足量的浓溴水反应最多可与6 mol Br2作用
查看答案和解析>>
网址:.(2)氧化剂与还原剂的物质的量之比是 .(3)若产生标况下22.4 L Cl2.则转 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/675454
相关内容
实验室可以用高锰酸钾和浓盐酸反应制取氯气.反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(1)用单线桥法标出电子转移的方向和数目 .(2)该反应中的氧化剂与还原剂物质的量之比是 .(3)KMnO4的氧化性比Cl2的氧化性 .(4)如反应中转移了2mol电子.则产生的Cl2在标准状况下体积为 题目和参考答案——青夏教育精英家教网——2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O (1)用单线桥表示出上述反应中电子转移的方向和数目 (2)上述反应中氧化剂与还原剂的物质的量比 (3)15.8g KMnO4能使多少克HCl被氧化? (4)产生的Cl2在标准状况下的体积为多少?( 题目和参考答案——青夏教育精英家教网——
NaClO +2HCl== NaCl +X + H2O, 则 X 的� 题目和参考答案——青夏教育精英家教网——
若ac=bc.则a=b.× 题目和参考答案——青夏教育精英家教网——
①2KOH + Cl2 = KCl + KClO + H2O ②6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O (1)该生产工艺应在 (填“温度较高 或“温度较低 )情况下进行, (2)写出工业上制取Cl2的化学方程式 , (3)在“反应液I 题目和参考答案——青夏教育精英家教网——
8Li+3 SOCl2=6 Li Cl+Li2 SO3+2S 题目和参考答案——青夏教育精英家教网——
选择环保的装修材料可以有效地减少居室污染.劣质胶合板释放出的主要污染物是( )A.NOB.COC.甲醛D.SO2 题目和参考答案——青夏教育精英家教网——
生活中常见的物质呈强酸性的是( )A.厕所清洁剂B.牛奶C.洗发水D.厨房洗涤剂 题目和参考答案——青夏教育精英家教网——
高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产.原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH主要的生产流程如下:(1)写出反应①的离子方程式 .(2)反应的温度.原料的浓度和配比对高铁酸钾的产率都有影响.图 题目和参考答案——青夏教育精英家教网——
第一届全国青年运动会于2015年10月18日在福州海峡奥体中心主体育场举行.福州市人民做了充分的准备.(1)游泳馆的泳池供水可采用二氧化氯(ClO2)做消毒剂.①二氧化氯中Cl的化合价为+4.②工业上制取ClO2的化学方程式为2NaClO2+Cl2=2X+2ClO2.写出X的化学式NaCl.(2)氯气也是常用的消毒剂.氯气杀菌消 题目和参考答案——青夏教育精英家教网——

