近几年.大气污染越来越严重.雾霾天气对人们的生活.出行.身体健康产生许多不利的影响.汽车尾气是主要的大气污染源.降低汽车尾气危害的方法之一是在排气管上安装催化转化器.发生的反应为:则,△H= kJ(用含a.b.c.d的式子表示).(2)某温度下.向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示 题目和参考答案——青夏教育精英家教网——
汽车尾气处理主要是通过安装催化转化器,将有害的一氧化碳、氮氧化物转化为无害的二氧化碳和氮气。 #生活常识# #环保节能技巧# #汽车尾气处理#
练习册系列答案
相关习题
科目:高中化学来源:题型:填空题
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)?n(HSO3-)变化关系如下表:
91:9
1:1
9:91
pH
8.2
7.2
6.2
(1)由上表判断NaHSO3水溶液显
__性,原因是
__。
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是
__。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为2?1,则滴入盐酸中n(HCl)为
__mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g)CH3OH(g)。
(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为
__,再加入1.0 mol CO后,重新达到平衡,CO的转化率
__(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数
__(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
有关键能数据如下:(单位:kJ/mol)
H—H
H—O
C—H
C—O
C=O
键能
435
463
413
356
745
写出甲醇气体完全燃烧生成气态水的热化学方程式:
__。
查看答案和解析>>
科目:高中化学来源:题型:填空题
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
②2CO(g) +O2(g) =2CO2(g) △H2
③2H2(g)+O2(g) =2H2O(g) △H3
则CO(g) + 2H2(g) CH3OH(g) 的△H= 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g)CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。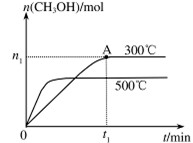
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数
(结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题: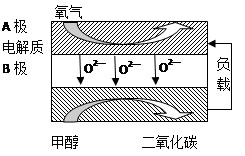
①B极的电极反应式为
。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是
。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀
(填“能”或“否”)。
查看答案和解析>>
科目:高中化学来源:题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3
CO
Fe
CO2
甲/mol
1.0
1.0
1.0
1.0
乙/mol
1.0
2.0
1.0
1.0
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。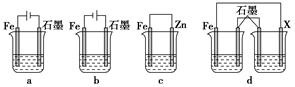
(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。
查看答案和解析>>
科目:高中化学来源:题型:填空题
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学来源:题型:填空题
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是_________________________________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_________________________________________________________________。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-===2CO32—+6H2O,该电池中正极上的电极反应式为____________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
查看答案和解析>>
科目:高中化学来源:题型:填空题
氨是最重要的化工产品之一。
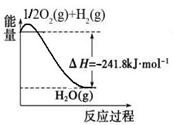
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。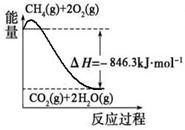

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。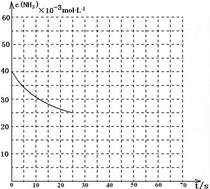
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
H2CO3
NH3·H2O
电离平衡常数
Ka1=4.30×10-7 Ka2=5.61×10-11
1.77×10-5
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈
性(填“酸”、“中”、“碱”),原因是
。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是
。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1
D.c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
网址:近几年.大气污染越来越严重.雾霾天气对人们的生活.出行.身体健康产生许多不利的影响.汽车尾气是主要的大气污染源.降低汽车尾气危害的方法之一是在排气管上安装催化转化器.发生的反应为:则,△H= kJ(用含a.b.c.d的式子表示).(2)某温度下.向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/131838
相关内容
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)已知:反应ⅠN2(g)+O2(g)=2NO(g)ΔH=akJ·mol-1反应Ⅱ2NO(g)+O2研究工业废弃物的处理和防治具有重要的意义.(1)利用反应CH4+2NO2=N2+CO2+2H2O可消除NO2的污染.该反应中氧化剂是NO2.当消耗CH 4的体积是11.2L时.理论上可处理1molNO 2.(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置.该装置能将CO和NO转化为参与大气循环的无毒气体. 题目和参考答案——青夏教育精英家教网——
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ·mol-1C
“低碳生活 既是时尚.也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.(1)在汽车排放气装置中安装一个净化器可以有效地处理汽车有毒尾气.如:CO(g)+HO2+CO2(g)△H=
二氧化碳的回收利用是环保和能源领域研究的热点课题.(1)新的研究表明.利用太阳能可以将CO2分解制取炭黑.其原理如右图所示.该过程的能量转化形式为 .在整个过程中.FeO的作用是 .已知:①2Fe2O4 ΔH=akJ/mol②C ΔH=bKJ/mol 则过程2的热化学方程式为 .(2)一定温度下.在密闭容器中进行反应CO22CO ΔH>0 题目和参考答案——青夏教育精英家教网——
煤的气化是高效.清洁的利用煤炭的重要途径之一.(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:①C(s)+O2 (g)=CO2 (g)△H=
下列有机物命名正确的是 A.CH2=CH
科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
十大热门车载空气净化器产品排行榜 值得入手的车载空气净化器推荐

