丙烯是重要的有机化工原料,丁烯催化裂解法是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:I主反应,3C4H8(g)=4C3H6(g)△H1
购买壁纸,选择无氯乙烯、丙烯酸酯等有害物质的环保型产品。 #生活常识# #日常生活小窍门# #室内装饰小技巧# #环保材料选购#
题型:解答题-原理综合题 难度:0.65 引用次数:253 题号:6220203
丙烯是重要的有机化工原料,丁烯催化裂解法是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:I主反应,3C4H8(g)=4C3H6(g) △H1
II副反应: C4H8(g)=2C2H4(g) △H2
(1) 已知丁烯的燃烧热△H3=-akJ/mol 丙烯的燃烧热△H4=-bkJ/mol。 计算: △H1=
kJ/mol
(2) 以ZSM-5分子筛作为催化剂,测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T) 和压强(p)变化的趋势分别如图1和图2所示: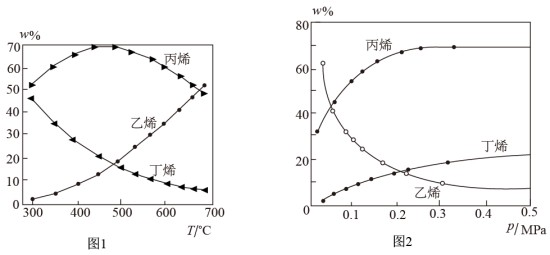
① 下列说法正确的是
。
A.随温度升高反应II的正反应速率增大,逆反应速率减小
B.温度可影响产物的选择性
C.根据350℃时各物质的质量分数可知,反应I的活化能低于反应II
D.制备丙烯适宜的温度和压强分别为600℃,0.5Mpa
②若某温度下反应达到平衡时C4H8、C3H6、C2H4的体积分数分别为20%、70%、10%,平衡时总压强为P,请计算该温度下反应的平衡常数Kp=
(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
③图2 中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是
。
(3) 在恒温恒容体系中,充入一定量的丁烯,转化率随时间的变化如图。在实际生产中,通常在恒压条件下以氮气作为反应体系的稀释剂,请在下图中画出恒压条件丁烯的转化率随时间变化由线
。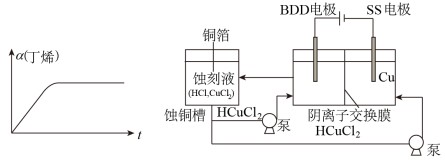
(4) 有研究者用HCl和CuCl2的混合液做蚀刻液,浸泡铜板可制备印刷电路板,蚀铜结束会产生大量含HCuC12废液。采用如图所示装置可直接从水中电解产生具有强氧化性的氢氧自由基(HO·),再进一步反应可实现阳极区蚀刻液再生的目的。
阳极区发生的反应为:
,H++CuCl2-+ HO·=Cu2++2Cl-+H2O
更新时间:2018/03/24 16:28:19 |
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐【推荐1】CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g)CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g)CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式
。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g)CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示: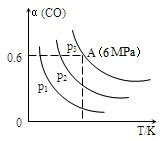
①p1、p2、p3中最大的是
。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为
mol·L-1·min-1。
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性
(填“减弱”、“增强”或“不变”),Y电极是
_____极,写出X电极上发生的电极反应式
__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为
_____L(标准状况下)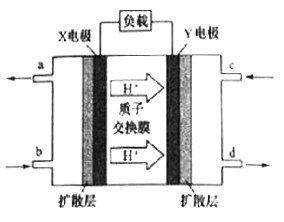
【推荐2】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=
________kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为
(填曲线标记字母),其判断理由是
___________________________________________________。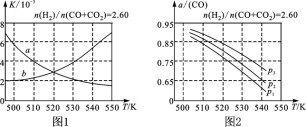
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
(填“增大”或“减小”),其原因是
______________________________________________________。图2中的压强由大到小为
__________,其判断理由是
___________________________________。
【推荐3】氢能是一种清洁能源,按照生产过程中的碳排放情况分为灰氢、蓝氢和绿氢。
(1)甲烷水蒸气催化重整制得
:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH>0。
①为提高CH4的平衡转化率,降低其在混合物中百分含量,可采取的措施有
。
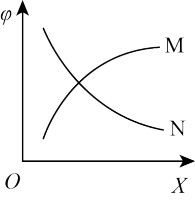
②下图中,X 为投料比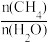 ,φ 为CH4的平衡转化率,其它条件不变,φ 随 X 的变化趋势曲线为
,φ 为CH4的平衡转化率,其它条件不变,φ 随 X 的变化趋势曲线为
。
③某条件下,若 CH4(g)、H2O(g)初始浓度均为 0.2mol/L,CH4的平衡转化率φ=25%,K=
。
(2)热化学硫碘循环分解水制得
,全程零碳排放。反应如下:
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。
①写出反应i 中K的表达式
。
②写出反应iii的热化学方程式
。
网址:丙烯是重要的有机化工原料,丁烯催化裂解法是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:I主反应,3C4H8(g)=4C3H6(g)△H1 https://www.yuejiaxmz.com/news/view/214254
相关内容
早在2004年.国家食品监督局就发出“警惕食品中丙烯酰胺(CH2=CHCONH2) 的公告.丙烯酰胺会在长期炸制食物过程中产生.具有中等毒性.它对人体可造成神经毒性和遗传毒性.已知:有机物H是丙烯酰——青夏教育精英家教网——高效液相色谱法测定生活饮用水中丙烯酸
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)已知:反应ⅠN2(g)+O2(g)=2NO(g)ΔH=akJ·mol-1反应Ⅱ2NO(g)+O2
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
聚苯乙烯在塑料包装中的应用概述 – 高分子网
二氧化碳的回收利用是环保和能源领域研究的热点课题.(1)新的研究表明.利用太阳能可以将CO2分解制取炭黑.其原理如右图所示.该过程的能量转化形式为 .在整个过程中.FeO的作用是 .已知:①2Fe2O4 ΔH=akJ/mol②C ΔH=bKJ/mol 则过程2的热化学方程式为 .(2)一定温度下.在密闭容器中进行反应CO22CO ΔH>0 题目和参考答案——青夏教育精英家教网——
氧化石墨烯=污水处理【钜大锂电】
[题目]生活中使用的塑料食品盒.水杯等通常由聚苯乙烯制成.其结构简式如图所示.根据所学知识.可以判断( ) A.聚苯乙烯能使溴水褪色B.聚苯乙烯是一种天然高分子化合物C.聚苯乙烯可由苯乙烯通过化合反应制得D.聚苯乙烯单体的分子式为C8H8 题目和参考答案——青夏教育精英家教网——
(1)硝化法是一种古老的生产硫酸的方法.同时实现了氮氧化物的循环转化.主要反应为:NO2SO3 ΔH=
甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g)CH3OH(g)ΔH1反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2①上述反应

