实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下: Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJ∙mol-
做糖溶于水的化学实验,理解溶解过程 #生活知识# #科技生活# #科学实验#
1.
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)
甲组的同学拟制备原料气NO和Cl2 , 制备装置如下图所示:
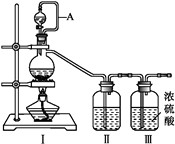
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ
装置Ⅱ
烧瓶中
分液漏斗中
制备纯净Cl2
MnO2
①
②
制备纯净NO
Cu
③
④
(2)
乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
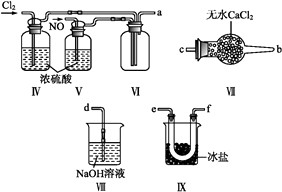
①装置连接顺序为a→(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是。
③装置Ⅶ的作用是。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为。
(3)
丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气,该反应的化学方程式为。
2.
硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
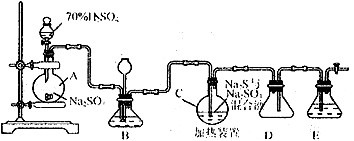
烧瓶C 中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S (aq) (Ⅰ)
2H2S (aq) +SO2(g)= 3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
(1)
烧瓶A 中发生反应的离子方程式为。装置D的作用是。
(2)
装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)
反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)
为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是。
(5)
Ⅱ.焦亚硫酸钠(Na2S2O5) 是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)
葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
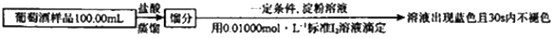
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g/L
②在上述实验过程中,HI 可能会被空气氧化,反应的化学方程式为。若有部分HI 被空气氧化,会导致测得的结果(填“偏高”“ 偏低”或“不变”)。
网址:实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下: Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJ∙mol- https://www.yuejiaxmz.com/news/view/244775
相关内容
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业制备无水AlCl3的流程如下:(1)已知:C(s)+12O2(g)═CO(g)△H=
近几年.大气污染越来越严重.雾霾天气对人们的生活.出行.身体健康产生许多不利的影响.汽车尾气是主要的大气污染源.降低汽车尾气危害的方法之一是在排气管上安装催化转化器.发生的反应为:则,△H= kJ(用含a.b.c.d的式子表示).(2)某温度下.向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示 题目和参考答案——青夏教育精英家教网——
二氧化碳的回收利用是环保和能源领域研究的热点课题.(1)新的研究表明.利用太阳能可以将CO2分解制取炭黑.其原理如右图所示.该过程的能量转化形式为 .在整个过程中.FeO的作用是 .已知:①2Fe2O4 ΔH=akJ/mol②C ΔH=bKJ/mol 则过程2的热化学方程式为 .(2)一定温度下.在密闭容器中进行反应CO22CO ΔH>0 题目和参考答案——青夏教育精英家教网——
氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2==Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),
已知:在氢氧化钠浓溶液中加入氧化钙.加热.制成的白色固体就是碱石灰.有两个实验小组的同学决定通过实验探究碱石灰的组成.(1)第一小组设计方案的流程如下:①写出n (OH
铁及其化合物在日常生活.生产中应用广泛.氯化铁和高铁酸钾都是常见的水处理剂.如图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程.请回答下列问题:(1)已知:①Fe2O3+3CO(g)△H=+489.0kJ•mol
利用右图所示装置可吸收SO2.并用阴极排出的溶液吸收NO2.下列说法正确的是A.a为直流电源的负极B.阴极的电极反应式为:2HSO+2H++e

