随着化石能源的大量开采以及污染的加剧.污染气体的治理和开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成,SO2 = 2HI ∆H=a kJ/mol ①2H2SO4 ——青夏教育精英家教网——
遵守《大气污染防治法》,尽量减少燃烧化石燃料,比如使用清洁能源。 #生活技巧# #环保生活理念# #环保法规#
随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) ∆H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) ∆H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) ∆H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) ∆H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。
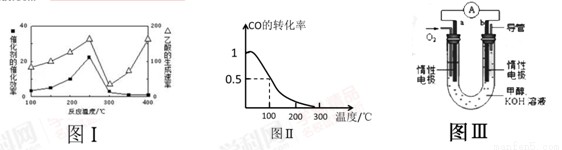
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
网址:随着化石能源的大量开采以及污染的加剧.污染气体的治理和开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成,SO2 = 2HI ∆H=a kJ/mol ①2H2SO4 ——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/334422
相关内容
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol(1) SO2+I2+2H2O=H2SO4+2HI (2) 2H2SO4=2SO2+O2+2H2O (3) 2HI=H2+I2 ——青夏教育精英家教网——
氢气是一种清洁能源.氢气的制取与储存是氢能源利用领域的研究热点.(1)以甲烷为原料制取氢气是工业上常用的制氢方法.已知:CH4(g)+H2O+3H2(g) ΔH=+206.2 kJ/molCH4——青夏教育精英家教网——
研究含氮污染物的治理是环保的一项重要工作.合理应用和处理氮的化合物.在生产生活中有重要意义.=2NO(g) △H=+180.5kJ•mol﹣12C △H=﹣221.0kJ•mol﹣1C △H=﹣393. 5kJ•mol﹣1则汽车尾气处理的反应之一:2NO+2CO2(g)△H= kJ•mol﹣1.利于该� 题目和参考答案——青夏教育精英家教网——
近几年.大气污染越来越严重.雾霾天气对人们的生活.出行.身体健康产生许多不利的影响.汽车尾气是主要的大气污染源.降低汽车尾气危害的方法之一是在排气管上安装催化转化器.发生的反应为:则,△H= kJ(用含a.b.c.d的式子表示).(2)某温度下.向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示 题目和参考答案——青夏教育精英家教网——
随着环保意识的增强.清洁能源越来越受人们关注.(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源. 硫
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=
(14分)钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用资源。已知:①3Fe2O2(s)+CO(g)2Fe3O2(s)+CO2(g)△H=—47kJ/mol②Fe3O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=—
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)已知:反应ⅠN2(g)+O2(g)=2NO(g)ΔH=akJ·mol-1反应Ⅱ2NO(g)+O2
甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:COCH3OH(g).已知①常压下反应的能量变化如图所示.②③CO ΔH=

