实验室可以用高锰酸钾和浓盐酸反应制取氯气.反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(1)用单线桥法标出电子转移的方向和数目 .(2)该反应中的氧化剂与还原剂物质的量之比是 .(3)KMnO4的氧化性比Cl2的氧化性 .(4)如反应中转移了2mol电子.则产生的Cl2在标准状况下体积为 题目和参考答案——青夏教育精英家教网——
酸雨是由于空气中的二氧化硫和氮氧化物与雨水反应形成的。 #生活知识# #科学#
考点:氧化还原反应,配制一定物质的量浓度的溶液
专题:实验题,氧化还原反应专题
分析:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,该反应中转移10e-,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
KMnO4固体配制100mL 0.5mol.L-1的溶液,需要100mL容量瓶、胶头滴管;并结合n=cV、m=nM及c=解答.
解答: 解:(1)Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,该反应中转移10e-,单线桥法标出电子转移的方向和数目为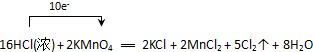 ,故答案为:
,故答案为: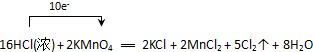 ;
;
(2)氧化剂为KMnO4,还原剂为HCl,氧化剂与还原剂物质的量之比是2:10=1:5,故答案为:1:5;
(3)由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为KMnO4>Cl2,故答案为:强;
(4)由反应可知,转移10e-生成5molCl2,则反应中转移了2mol电子,则产生的Cl2在标准状况下体积为1mol×22.4L/mol=22.4L,故答案为:2.24;
(5)①KMnO4固体配制100mL 0.5mol.L-1的溶液,需要100mL容量瓶,定容需要胶头滴管,故答案为:胶头滴管;100mL容量瓶;
②需要固体的质量为0.1L×0.5mol/L×158g/mol=7.9g,故答案为:7.9;
③A.加水定容时俯视刻度线,溶液的体积偏小,则浓度偏大,故A不选;
B.容量瓶内壁附有水珠而未干燥处理,后来还需定容加水,对实验无影响,故B不选;
C.颠倒摇匀后发现凹液面低于刻度线又加水补上,溶液体积偏大,则浓度偏小,故C选;
D.在溶解过程中有少量液体溅出烧杯外,溶质减少,则所得溶液浓度偏小,故D选;
故答案为:CD.
点评:本题考查氧化还原反应和溶液的配制,为高频考点,把握反应中元素的化合价变化及溶液配制步骤为解答的关键,侧重基本概念及转移电子及实验分析能力的考查,题目难度不大.
网址:实验室可以用高锰酸钾和浓盐酸反应制取氯气.反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(1)用单线桥法标出电子转移的方向和数目 .(2)该反应中的氧化剂与还原剂物质的量之比是 .(3)KMnO4的氧化性比Cl2的氧化性 .(4)如反应中转移了2mol电子.则产生的Cl2在标准状况下体积为 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/351946
相关内容
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O (1)用单线桥表示出上述反应中电子转移的方向和数目 (2)上述反应中氧化剂与还原剂的物质的量比 (3)15.8g KMnO4能使多少克HCl被氧化? (4)产生的Cl2在标准状况下的体积为多少?( 题目和参考答案——青夏教育精英家教网——15.亚硫酸钠在空气中易被氧化生成硫酸钠.现有ag亚硫酸钠样品.溶解后加入足量氯化钡溶液.可得干燥沉淀bg. (1)若亚硫酸钠未被氧化.b= a. (2)若亚硫酸钠全被氧化.b= a.——青夏教育精英家教网——
二氧化锰因在工业生产中应用广泛而备受关注.制备二氧化锰是一项有意义的工作.某研究性小组对此展开了系列研究.Ⅰ.用高锰酸钾制备资料一:3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O. K2MnO4易溶于水(1)实验室加热高锰酸钾制氧气.反应的化学方程式为 .将反应后的固体剩余物用稀硫酸浸取一段时间后过滤.洗涤.烘干即 题目和参考答案——青夏教育精英家教网——
第一届全国青年运动会于2015年10月18日在福州海峡奥体中心主体育场举行.福州市人民做了充分的准备.(1)游泳馆的泳池供水可采用二氧化氯(ClO2)做消毒剂.①二氧化氯中Cl的化合价为+4.②工业上制取ClO2的化学方程式为2NaClO2+Cl2=2X+2ClO2.写出X的化学式NaCl.(2)氯气也是常用的消毒剂.氯气杀菌消 题目和参考答案——青夏教育精英家教网——
高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产.原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH主要的生产流程如下:(1)写出反应①的离子方程式 .(2)反应的温度.原料的浓度和配比对高铁酸钾的产率都有影响.图 题目和参考答案——青夏教育精英家教网——
利用下图装置加入适当试剂可完成某些探究实验,并得出相应实验结论。某探究小组进行某次探究实验所用试剂或所得结论列于表中,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。请
科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH
漂白粉.漂白液可用于游泳池及环境消毒剂.(1)氯气Cl2通入到消石灰中可得到以次氯酸钙Ca(ClO)2为有效成分的漂白粉.请完成反应的化学方程式:2Cl2+2 =Ca(ClO)2+ +2H2O(2)氯气Cl2通入到烧碱溶液中可得到以次氯酸钠为有效成分的漂白液.反应原理与上述反应相似.请写出此反应的化学方程式: ,(3)请推测HClO的名称是 . 题目和参考答案——青夏教育精英家教网——
含氯消毒剂在生产、生活中有着广泛的用途。(1)工业上将Cl2溶于一定浓度的NaOH溶液,可制得“84”消毒液,反应的离子方程式为
用所学的化学知识填空(1)洗涤剂能去除油污.是因为它具有乳化功能,(2)用化学方程式表示CaO可用作食品干燥剂的原因为CaO+H2O=Ca(OH)2,(3)稀盐酸与稀硫酸化学性质相似.是因为在它们的溶液中都含有H+. 题目和参考答案——青夏教育精英家教网——

