[题目]高铁酸钠(Na2FeO4)是一种高效多功能水处理剂.工业上常采用次氯酸钠氧化法生产.反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O 中Cl元素的化合价为 ,(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为 ,(3)现要制得830kg含杂质20%的高铁酸钠 题目和参考答案——青夏教育精英家教网——
食盐和味精不是同一种,食盐主要成分是氯化钠,味精是谷氨酸钠。 #生活常识# #生活安全# #食品添加剂识别#
【题目】高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为_____;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_____ (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少_________?(列式计算)
试题答案在线课程【答案】 +1 7:8 447kg
【解析】
本题考查了根据化学式、化学方程式的计算。难度不大,计算时要注意规范性和准确性。
(1)在NaClO中,钠元素的化合价为+1价,氧元素的化合价为﹣2价,设:次氯酸钠中氯元素的化合价为x,根据化合物中元素的正负化合价的代数和为0,则+1+x+(﹣2)=0,解得x=+1;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量之比为56:(16×4)=7:8;
(3)设:次氯酸钠的质量为x,
3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
223.5 332
x 830kg×80%
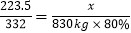 x= 447Kg
x= 447Kg
答:至少需要次氯酸钠的质量是447kg。
练习册系列答案
相关习题
科目:初中化学来源:题型:
【题目】民间常用川乌、草乌泡制药酒。川乌、草乌中含有少量有毒物质乌头碱(化学式为 C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法正确的是( )
A. 乌头碱中氮元素与氧元素的质量比为1:11
B. 乌头碱分子中C、H原子个数比为34:47
C. 乌头碱在空气中充分燃烧只生成CO2和H2O
D. 乌头碱由93个原子构成
查看答案和解析>>
科目:初中化学来源:题型:
【题目】宏观和微观相联系是化学独特的思维方式。
(1)①将稀硫酸(甲)逐滴滴入含有酚酞的 NaOH溶液(乙)中,并不断搅拌的原因是___________,说明恰好完全反应(丙)的现象是______________。下图所示是以上反应的微观解释。
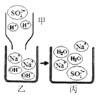
②若要证明使酚酞变化的粒子不是Na+,需选择甲、乙、丙中的__________________。(填“甲”“乙”“丙”)
③已知水能较少量地解离为H+和 OH-且两者数目相等。若稀硫酸过量一滴,请从微观角度解释,溶液显酸性的原因是__________________________。
(2)化学上有一种能将微观粒子数量与宏观物质质量联系起来的量,叫物质的量,其单位是摩尔。1摩尔任何物质中含有构成它的微粒个数都是 6.02×1023个,1摩尔任何物质的质量是以克为单位,数值上都等于该物质的相对分子质量。例如1摩尔水的各种量关系如下:
①1摩尔水分子中氢原子数目是_______个;②1摩尔水中氧元素质量为_______g。
(3)某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题:
时间
质量/g
水
饱和石灰水
稀盐酸
浓硫酸
氯化钠浓溶液
氯化钙浓溶液
1天
8.16
8.37
8.64
11.18
9.38
10.25
2天
5.76
5.94
6.69
12.55
8.47
10.33
①下列图示能反映水在空气中放置时发生变化的微观示意图是________________(填字母序号)。(图中 表示氧原子, 表示氢原子)
A.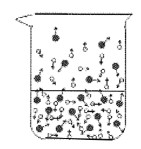
B.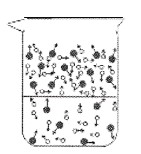
C.
D.
②为研制一种安全、环保的除湿剂,可选择上表中的________________(填溶质的化学式)。
查看答案和解析>>
科目:初中化学来源:题型:
【题目】实验是进行科学探究的主要方法。如图是初中化学常见装置,请回答:
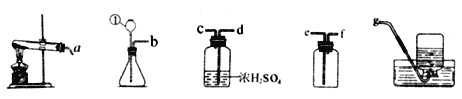
(1)仪器①的名称是_____________________________。
(2)实验室用纯净物制取O2的化学方程式是______________________________。
(3)欲用活泼金属与稀硫酸反应制取干燥的H2,请从这些装置中选择并连接一套组合装置,按照气流从左到右的流向,写出所选装置接口的连接顺序:_________________。
(4)在实验室,小宇同学为验证CO2的性质,将制取的气体通入澄清石灰水中,发现澄清石灰水不变浑浊,分析其中的原因可能是_____________________。
查看答案和解析>>
科目:初中化学来源:题型:
【题目】如图是元素周期表的一部分。
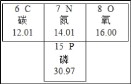
(1)碳的相对原子质量为_____。
(2)C、N、O元素处于同一周期是因为_____。
(3)氮元素、磷元素化学性质相似的原因是_____。
查看答案和解析>>
科目:初中化学来源:题型:
【题目】氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如下:
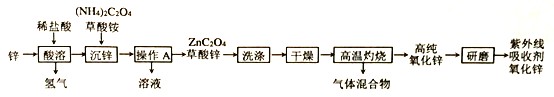
(1)推测草酸的化学式是____________;
(2)“沉锌”过程中发生复分解反应,反应的化学方程式是_______________________________
(3) “操作A”的名称是______________ 实验室常用的研磨仪器是_____________;
(4)“高温灼烧”时草酸锌分解,反应的化学方程式是______________________________。
查看答案和解析>>
科目:初中化学来源:题型:
【题目】日常生活中的不少用品与水银有关,体温计就是其中之一。小明偶患感冒,量体温时不小心将体温计滑落摔碎,地面上散落许多水银珠。小明就想:水银有毒吗?怎样清理?经网络搜寻,小明获取以下有关水银的资料:


水银学名为汞(Hg),常温下是银白色液体,密度大,易蒸发且吸附性特别好,不溶于水,汞及汞的大多数化合物有毒。汞在化合物中常表现为+2价,能与硫反应生成不易溶于水的无毒物质——硫化汞。
依据以上信息和小明的做法,完成下面问题:
⑴小明关掉室内所有热源,开窗通风,这样做的目的是 ;
⑵小明戴上手套以避免 ,用小勺把水银收集到盛有 的玻璃瓶中,送交实验室。
⑶最后,小明又向不易收集的细小水银珠上布撒硫磺粉降低危害,他的依据是 (用化学方程式表示)。
查看答案和解析>>
科目:初中化学来源:题型:
【题目】食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。

①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和 。
②在蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
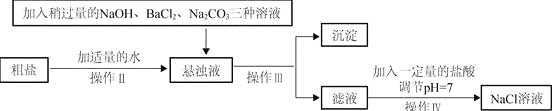
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是 (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有 (用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。已知:20 ℃时氯化钠的溶解度为36g。
查看答案和解析>>
科目:初中化学来源:题型:
【题目】(1)化石燃料包括__________,化石燃料的特点是__________(填字母序号).
A.不可再生 B.清洁燃料 C.资源有限 D.新型能源
(2)在如图1的图表中,汽车加油站不必设置的有__________(填字母序号).车用乙醇汽油可节省石油资源,减少汽车尾气的污染.乙醇在空气中燃烧的化学方程式为__________.
(3)用二氧化碳灭火器(如图2)灭火时,手一定要握在钢瓶的木柄上,以免冻伤.由此可知二氧化碳灭火器的灭火原理是__________

查看答案和解析>>
网址:[题目]高铁酸钠(Na2FeO4)是一种高效多功能水处理剂.工业上常采用次氯酸钠氧化法生产.反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O 中Cl元素的化合价为 ,(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为 ,(3)现要制得830kg含杂质20%的高铁酸钠 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/351952
相关内容
高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产.原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH主要的生产流程如下:(1)写出反应①的离子方程式 .(2)反应的温度.原料的浓度和配比对高铁酸钾的产率都有影响.图 题目和参考答案——青夏教育精英家教网——高铁酸钾是一种新型高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO43NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3N
铁及其化合物在日常生活.生产中应用广泛.氯化铁和高铁酸钾都是常见的水处理剂.如图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程.请回答下列问题:(1)已知:①Fe2O3+3CO(g)△H=+489.0kJ•mol
由于高铁列车车厢是密闭的空间.因此提供清洁的空气.保持车厢的卫生非常重要高铁酸钠是高铁上常用的一种“绿色环保高效 消毒剂.下面是一种制备高铁酸钠的反应原理:Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2X.下列说法不正确的是( )A. X的化学式为H2OB. NaNO2中氮元素的化合价是+5价C. 高铁酸钠具有强氧化 题目和参考答案——青夏教育精英家教网——
在四个同样密闭容器中发生反应:A.在同一时间内测得容器内的反应速率:甲为:v,乙为v(B)=4.5mol/=4mol/=0.75mol/.若其它条件相同.温度不同.则温度由低到高的顺序是乙<丙<甲<丁. 题目和参考答案——青夏教育精英家教网——
15.亚硫酸钠在空气中易被氧化生成硫酸钠.现有ag亚硫酸钠样品.溶解后加入足量氯化钡溶液.可得干燥沉淀bg. (1)若亚硫酸钠未被氧化.b= a. (2)若亚硫酸钠全被氧化.b= a.——青夏教育精英家教网——
某氢氧化钠样品中混有氯化钠.为测定样品中氢氧化钠的质量分数.称取5 g样品.加入27 g水完全溶解后.缓慢加入稀盐酸.同时测定溶液的pH.当pH=7时.刚好用去10%的稀盐酸36.5 g.试计算:(1)将100 g质量分数为38%的浓盐酸稀释成10%的稀盐酸.需加水的质量为 g.(2)样品中氢氧化钠的质量分数.(3)反应后所得溶液中溶质的质量分数. 题目和参考答案——青夏教育精英家教网——
加碘食盐中含有碘酸钾.现以电解法制备碘酸钾.实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液.发生反应:3I2+6KOH=5KI+KIO3+3H2O.将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区.开始电解.下列说法中正确的是A.电解过程中OH
“低碳生活.绿色出行 .学校建议同学们骑自行车出行.请回答下列问题(1)图中所标示的各部件中.属于金属材料的是 (2)自行车车架一般用生铁制造.某些部件为不锈钢.工业上常以赤铁矿为原料炼铁.请写出一氧化碳与氧化铁在高温下反应的化学方程式: (3)车架表面喷漆不仅美观.而且可有效防止其与 接触而生锈.防止公共自行车链条生锈� 题目和参考答案——青夏教育精英家教网——
亚硝酸钠(NaNO2)是一种污染物.有毒.金属加工废切削液中常含此物质.人们常用以下方法来处理:第一步:NaNO2+NH4Cl=NH4NO2+NaCl 第二步:NH4NO2 △ . X↑+2H2O X的化学式为 . 题目和参考答案——青夏教育精英家教网——

