电化学在日常生活中用途广泛.图甲是镁
剪刀是厨房中常见的工具之一,它的用途非常广泛。 #生活常识# #剪刀#
电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含的工业废水的处理。下列说法正确的是
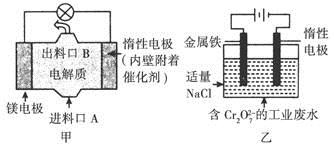
A.图乙中向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
B.图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生
C.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D.若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀
试题答案在线课程C
【解析】
A项,在电解池中,阴离子应该移向阳极,根据装置乙可知,惰性电极做阴极;B项,未标明标准状况,故无法计算产生气体的体积;C项,根据装置甲可知,镁做负极,发生电极反应是Mg-2e-=Mg2+;D项,图甲中溶解3.6 g镁时,失去的电子是0.3 mol,在图乙中阳极反应是Fe-2e-=Fe2+,根据电子守恒可得此时生成的Fe2+是0.15 mol,所以最后生成的氢氧化铁也是0.15 mol即16.05 g。
练习册系列答案
相关习题
科目:高中化学来源:2014高考名师推荐化学离子方程式正误判断(解析版)题型:选择题
能正确表示下列反应的离子方程式是
A.硫酸铝溶液中加入过量氨水 Al3++3OH-= Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-= CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-= ClO-+Cl-+H2O
D.稀硫酸中加入铁粉 2Fe+6H+= 2Fe3++3H2↑
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学盖斯定律及其应用(解析版)题型:选择题
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学电解规律及电化学计算(解析版)题型:选择题
体积为1 L的某溶液中含有的离子如表所示:
离子
Cu2+
Al3+
Cl-
1
1
a
1
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是
A.电解后溶液的pH=0
B.a=3
C.阳极生成1.5 mol Cl2
D.阴极析出的金属是铜与铝
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版)题型:填空题
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:
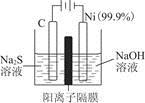
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,
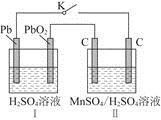
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
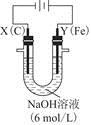
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学电解三池的应用(解析版)题型:选择题
下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学电解三池的应用(解析版)题型:选择题
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
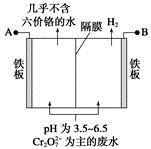
A.A为电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H213.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学物质结构与性质推断(解析版)题型:填空题
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 。
(3)X与Z中电负性较大的是 。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为 ,此离子中所含化学键的类型是 ,X—Z—X的键角 109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
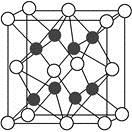 (4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为 g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学来源:2014高考名师推荐化学物质的分离和提纯(解析版)题型:实验题
菠菜营养丰富,长期以来民间流传着“菠菜不能与豆腐同食”的说法。某学校化学兴趣小组的同学拟通过实验探究:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4·2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体。
他们设计的实验步骤如下:
1.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液(含有少量杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
2.用草酸晶体(H2C2O4·2H2O)做以下实验:
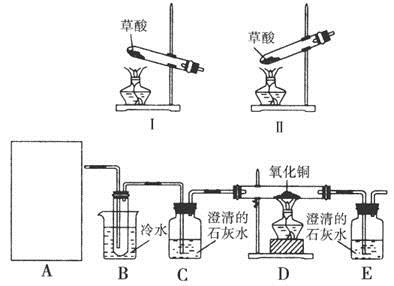
请回答以下问题:
(1)步骤1中加入CH3COOH溶液的作用: 。
(2)A处应选择 (填“Ⅰ”或“Ⅱ”),在做实验之前,应先 。
(3)实验2过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中草酸晶体(H2C2O4·2H2O)发生反应的化学方程式: ,装置B的作用是 。
(4)为使实验结论更加严密和安全,在以上所连接的装置C、D间还需依次添加装有 、 、 (液体试剂)的洗气瓶,此外指出上述装置中的不足之处还有 。
查看答案和解析>>
网址:电化学在日常生活中用途广泛.图甲是镁 https://www.yuejiaxmz.com/news/view/418376
相关内容
电化学在日常生活中用途广泛.图①是镁次氯酸钠燃料电池.电池总反应为Mg+ClO如图是镁
甲烷作为一种新能源在化学领域应用广泛.请回答下列问题:(1)甲烷
嵌入式系统在日常生活中有着非常广泛的应用领域
铜及其化合物在工业生产和日常生活中有着广泛的应用。(1)Li
物联网技术在日常生活中的广泛应用
Excel在日常生活中最佳用途 – INFOXIAO
生物识别技术在日常生活中的广泛应用及数据安全
(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:(1)铁元素在周期表中的位置是。(2)写出Fe与稀硫酸反应的离子方程式。(3)已知:Fe2O3(s)+C(s)=CO
工具钢在日常生活中的 8 种用途

