研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。①该反应为
燃料电池汽车利用化学反应产生电能 #生活知识# #科技生活# #科技改变生活# #新能源应用#
题型:解答题-实验探究题 难度:0.85 引用次数:203 题号:8847381
研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。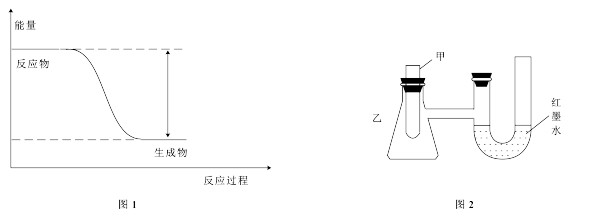
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为
(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是
。
③若要使该反应的反应速率加快,下列措施可行的是
(填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
①铜为
(填“正”或“负”)极;负极的电极反应式为
______。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是
L。
更新时间:2019/10/12 09:40:40 |
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐【推荐1】某同学进行如下实验,探究化学反应中的能量变化。
通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低。由此判断NaOH溶液跟盐酸的反应是
(填 “吸热”或“放热”)反应,Ba(OH)2· 8H2O跟NH4Cl的反应是
____________(填“吸热”或“放热”)反应。反应①中反应物的总能量
_____________填(“大于”、“小于”或“等于”)生成物的总能量。反应②中断开反应物中的化学键所吸收的能量
_____________填(“大于”、“小于”或“等于”)形成生成物中的化学键所放出的能量。
【推荐3】(1)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。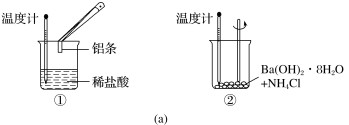
实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是
(填“吸热”或“放热”,下同)反应,Ba(OH)2·8H2O与NH4Cl的反应是
__反应。反应
__(填“①”或“②”)的能量变化可用图(b)表示。
(2)已知:4HCl+O2=2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量,则断开1mol H-O键与断开1mol H-Cl键所需能量相差约为
kJ。
网址:研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。①该反应为 https://www.yuejiaxmz.com/news/view/486528
相关内容
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.(1)在定向爆破中.常利用氧化铁与铝反应放出的热量来切割钢筋.该反应的化学方程式为__.(2)已知:2Fe2O3=3CO2 △H=+468.2 kJ·mol废旧金属可以回收利用.用合金废料制取FeSO4溶液和回收金属Cu.实验流程如图所示:(1)合金属于混合物(填“纯净物 或“混合物 ).(2)生活中铝比铁更耐腐蚀的原因4Al+3O2=2Al2O3.(3)步骤A化学反应方程式表示为:2Al+2NaOH+2R═2NaAlO2+3H2↑.依据质量守恒定律推出R的化学式为H2O.(4)步骤B发生的化学方程式为 题目和参考答案——青夏教育精英家教网——
科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH
化学反应有多种分类方法.(1)化学反应可分为氧化还原反应和非氧化还原反应.某种元素化合价在化学反应前后发生了变化.则该反应为氧化还原反应.据此可判断下列化学反应属于氧化还原反应的是②⑤⑥.①Zn0+H2SO4=ZnS04+H20②Fe2O3+3C0$\frac{\underline{\;高温\;}}{\;}$2Fe+3C02③Na2C03+ 题目和参考答案——青夏教育精英家教网——
如图是反映某个化学反应里各物质质量与时间的变化关系.下对此变化的描述中.正确的是( )A.反应了此化学反应是分解反应B.物质甲的相对分子质量大于乙C.此化学反应中.不遵守质量守恒定律D.充分反应后.乙+丙=甲的质量 题目和参考答案——青夏教育精英家教网——
二氧化碳的回收利用是环保和能源领域研究的热点课题.(1)新的研究表明.利用太阳能可以将CO2分解制取炭黑.其原理如右图所示.该过程的能量转化形式为 .在整个过程中.FeO的作用是 .已知:①2Fe2O4 ΔH=akJ/mol②C ΔH=bKJ/mol 则过程2的热化学方程式为 .(2)一定温度下.在密闭容器中进行反应CO22CO ΔH>0 题目和参考答案——青夏教育精英家教网——
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol
侯氏制碱法的主要反应之一为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.下面对该反应涉及的有关知识发表的部分见解.其中不正确的是( ) A.此反应可以获得固态氮肥B.NH3中氮元素的化合价为
甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:COCH3OH(g).已知①常压下反应的能量变化如图所示.②③CO ΔH=
把一根表面生锈的铁钉投入过量稀硫酸中.可以看到溶液颜色变为黄色.过一会有气泡产生,其化学方程式分别为Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O.Fe+H2SO4=Fe SO4+H2↑. 题目和参考答案——青夏教育精英家教网——

