重磅综述
文献综述的方法和技巧 #生活技巧# #学习技巧# #学术论文写作技巧#
编译:微科盟沐木,编辑:微科盟茗溪、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
大量的微生物,包括许多新的、系统发育上深厚的类群,能够在极端的环境中生存和繁衍。这些独特且简化的生态系统为研究自然微生物群落的结构、功能和进化提供了良好的机会。
基因标记研究已经被用于研究这些极端生境中微生物组合的模式和生态驱动因素,揭示了大量未培养微生物的多样性,以及在最极端条件下古菌通常会占据优势的特点。
新的组学研究揭示了群落功能和环境变量之间的联系,并使重大新谱系的发现和基因组特征的呈现成为可能,这大大扩展了微生物的多样性,改变了系统发育的结构。这些努力极大地促进了我们对地球极端环境中微生物的多样性、生态学和种群进化的理解,并促进了对更复杂生态系统中微生物群的形成以及发展进程的探索。
论文ID
原名:Microbial diversity in extreme environments
译名:极端环境中微生物的多样性
期刊:Nature Reviews Microbiology
IF:78.297
发表时间:2021.11
通讯作者:束文圣 & 黄立南
通讯作者单位:华南师范大学生命科学学院 & 中山大学生命科学学院
DOI号:10.1038/s41579-021-00648-y
综述目录
1 前言
2 微生物多样性和微生物的主要新谱系
2.1 陆地地热喷泉 2.2 深海热液喷口 2.3 冰冻圈 2.4 高盐环境 2.5 地下环境 2.6 酸性矿井排水 2.7 其他极端环境
3 群落的功能和动态
4 极端环境中微生物的进化
5 结束语
主要内容
1 前言
极端环境,如陆地温泉和深海热液喷口,冰川和永久冻土,高盐生境,酸性矿井排水(AMD),广泛分布在全球各地(图1)。尽管这些极端环境生存条件恶劣(图1),但这些生境为来自所有三个生命领域的广泛微生物提供了多样的生态位。微生物已经进化出不同的策略来应对极端(BOX1)的环境压力,定义了生命生存的物理和化学极限。一些极端环境由于其较低的生物复杂性、非培养分子分析的整体可操作性以及地球化学和生物过程之间的紧密耦合,成为微生物生态、进化和环境适应研究的理想之地(BOX2)。
一直以来,微生物学家主要依靠培养的方法开展研究。因此,早期的生理生态学研究主要集中在一些相对容易从各种极端生境中分离出来的“模式”微生物上。后来的独立培养调查(例如,16S核糖体RNA基因克隆文库分析)方法,揭示了微生物有着巨大的多样性,这在纯培养中是无法体现的。此外,高通量基因标记测序使微生物多样性得到更深入、更广泛的分析,这种技术也被应用于检查更广泛的微生物分布模式以及去寻找影响这些微生物大规模生态范围的因素。总之,这些分子研究手段大大扩展了我们对地球上主要极端环境中微生物多样性的认识,揭示了微生物群落具有相对较低至中等复杂性,以及广泛地理分布的少数优势物种的高丰度特征。
新的基因组测序和计算方法的应用为全面了解不同时空尺度和沿着特定地球化学梯度的微生物群落代谢能力和动态特征提供了技术支持。更重要的是,有利于对未开发门级群落基因组(候选门)的研究,这大大扩展了我们对生命树的看法。这些基因组数据为研究古细菌和细菌的代谢多样性和生态作用,以及早期生命的进化和真核生物的起源提供了新的视角。
本文综述了目前对地球主要极端环境中细菌和古菌的多样性、生态和进化的相关研究。
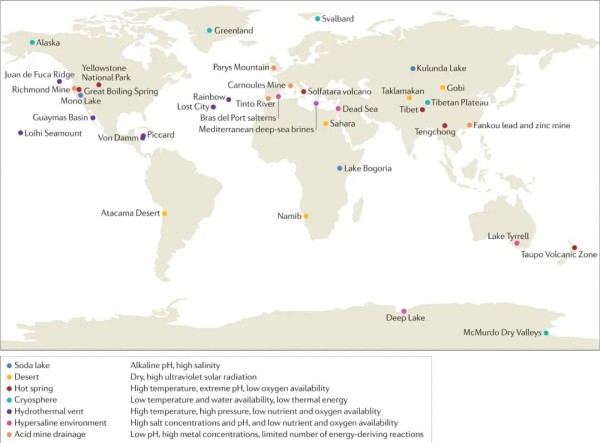
图1. 代表性极端环境的全球分布:每个极端环境点都标有特定的颜色。 每个极端环境都会对其生存的微生物群落多重胁迫(左下)。
Box 1. 微生物对极端环境的适应
极端环境具有极高或极低的温度或pH值,高盐度或高压力,低水平的营养素及其特定组合,对生存有着重大挑战。然而,一些微生物(极端微生物)在胁迫条件下已经进化为独特的存活策略(大多数极端微生物需要这种条件才能生长和繁殖)。已经进行了广泛的研究以揭示它们在分子水平上的适应性。
嗜热菌的高温适应: 通过增加饱和脂肪酸与不饱和脂肪酸(细菌)的比例或采用单脂层(古菌)来修改细胞膜;生产热休克蛋白和热稳定蛋白;通过具有高G+C含量或通过嗜热特异性酶反向DNA促旋酶引入的正超螺旋来维持DNA稳定性。
嗜冷菌的低温适应: 改变细胞膜的脂质组成(例如,通过增加不饱和脂肪酸与饱和脂肪酸的比例)以保持流动性;产生使细胞能够在低温条件下存活的专门蛋白质或其他分子(例如,冷适应蛋白质,冷休克蛋白质,冷适应蛋白质,抗冻剂和冰结合蛋白质以及渗透物);进入休眠状态限制代谢活动。
嗜盐菌的高盐适应性:通过在细胞质中积累(通过K+/Na+逆向转运蛋白)高水平的无机盐(KCl)来维持渗透稳态(“盐入”策略,主要见于古细菌);通过生物合成和/或积累有机和相容的渗透溶质实现渗透平衡,从而从细胞质中排除盐(“盐析”策略,主要见于细菌和真核生物)。
嗜酸菌中的酸适应:限制质子通过反向膜电位或高度不可渗透的细胞膜流入细胞质,促进过量的质子外流,有机酸降解或次级转运蛋白占优势;用细胞质缓冲维持细胞内pH值,用“铁铆钉”稳定蛋白质结构和酶的功能,当质子进入细胞质后,用伴侣修复低pH值造成的DNA和蛋白质损伤。
嗜酸菌中的金属适应:促进有毒金属从细胞质中流出,通过细胞内或细胞外结合隔离金属以降低其毒性作用,排除具有渗透屏障的金属,改变细胞成分以降低细胞靶标对有毒金属的敏感性,并将金属酶促转化为毒性较低的形式;将游离金属与硫酸盐络合以防止金属离子进入细胞,并通过内部阳性细胞质跨膜电位建立对金属流入的被动耐受性。
Box 2. 极端环境作为微生物生态学研究的模型。
天然微生物群落具有固有的多样性和复杂性。我们无法在环境中培养大多数微生物,因此无法深入了解这些生态群落的组装、动态和进化。
极端环境中微生物组合的多样性相对较低。这些独特的生态系统由于其生物学和地球化学上的简单性、自我可持续性和明显的物种相互作用、无机过程和生物过程之间的紧密耦合以及强烈的环境梯度,具有作为微生物生态学和进化研究模型的潜力。
然而,许多极端环境的微生物探索面临着重大挑战,特别是与采样(技术和资金方面)和核酸提取(低生物量和干扰物质问题)相关的困难。尽管如此,有一些系统在分子分析和整体处理方面特别突出。这些例子包括美国铁山里士满矿的酸性矿井排水生物膜,以及美国黄石国家公园的碱性硅质温泉中的蓝藻菌垫(具有极低的多样性群落),西班牙的圣波拉多池盐场群落。墨西哥Guerrero Negro的高盐席(群落沿盐度或环境梯度表现出明显的组成和功能变化)、南美洲阿塔卡马沙漠盐岩结核中的嗜盐微生物群落(每个结核代表一个接近封闭的微型生态系统,其中包含一个易受环境变化影响的特殊群落),新西兰地狱火山口湖(微生物种群随着独特的周期性热分布而波动,其中春季化学成分保持稳定)等等。
值得注意的是,里士满矿山的嗜酸生物膜已经成功地用于各种分子和组学方法的开发和改进,这些方法随后被广泛应用于中等多样性甚至中等高度多样性的群落。总之,几十年来广泛的分子和宏组学研究极大地提高了我们对极端环境下生物多样性、群落结构和功能、种群动态和进化的理解。这些进展促进了我们对其它更复杂的自然微生物生态系统的探索。
2 微生物多样性和微生物的主要新谱系
生物多样性相对较低的极端环境,特别是美国黄石国家公园(Yellowstone National Park,YNP)的陆地地热泉,在早期的自然生态系统的16S rRNA基因克隆文库中占据显著地位,关于它的研究彻底改变了我们对地球微生物多样性的理解。随后进行的广泛基因研究为聚集在各种极端生境微生物的组成和多样性做出了一个相对全面的解释,最终的结果得到了的宏基因组分析技术(metagenomic analysis)的支持(图2)。
极端环境由于其在多个地理尺度上的离散分布,有着广阔的地球化学和物理梯度以及微生物群落结构相对受限,特别适合微生物生物地理学的研究。虽然极端生境中微生物群落潜在的生态和进化过程及其它们产生的相关影响仍然知之甚少,但高通量16S rRNA扩增子测序(16S rRNA amplicon sequencing)已经能够对这些极端微生物大规模生态范围的模式进行表征。 尽管在极端环境中已经发现了大量以前未知的微生物,但由于缺乏纯培养,我们对它们的生理学和生态学的了解受到了阻碍。
基因组解析的宏基因组学和单细胞基因组学可以直接从环境中重建接近完整的微生物基因组,为这些神秘的极端微生物的代谢潜力和进化史提供了初步的见解。极端环境的基因组分析也使许多之前被基因标记分析忽略的主要、深分支谱系的发现和基因组的表征变得可行。总之,这些独立培养的基因组学研究已经极大地扩展了生命树系统发育的广度和基因组的表达,尤其是在古细菌领域(图3)。
2.1 陆地地热喷泉
地球上存在各种各样的陆地地热喷泉(例如,YNP拥有超过14000个温度范围为40~92℃的地热特征),开创了极端环境微生物研究的先河,并历史性地发了嗜热菌(Thermophily)。以培养为基础的研究和分子调查已经确定,世界各地采集的温泉水样本中,产水菌门(Aquificae)、变形菌门(Proteobacteria)和泉古菌门(Crenarchaeota)往往占主导地位(图2)。重要的类群包括碳同化型Hydrogenobaculum spp.、硫氧化型热变形菌属(Thermoproteus spp.)和硫化叶菌属(Sulfolobus spp.),以及固氮型嗜酸硫杆菌属(Acidithiobacillus spp.)。在同一泉源的水和沉积物微生物群落之间发现具有显著的差异,这种生态分化可能是由资源可用性(例如,溶解基质或最低基质)的差异驱动的。
具体来说,沉积物群落表现出相对较高的物种均匀性,并以矿物基代谢作用(如硫氧化或还原作用或铁氧化物还原作用)相关的类群为主。在YNP的碱性硅质泉中生长的微生物席已得到广泛的研究,显示其群落多样性极低,主要以来自蓝藻细菌(Synechococcus spp.聚球藻属)和绿弯菌门(Roseiflexus和Chloroflexus spp.嗜热光合属和绿弯菌属细菌)的叶绿素光养细菌(chlorophototrophs)占优势。
在不同的空间和时间尺度下的微生物生物地理学研究中,温度是影响群落组成的最大因素。然而,最近,对来自新西兰陶波火山带925个温泉的大量16S rRNA基因数据集的空间统计分析发现,温度仅在70℃以上对多样性有显著影响,低于70℃时pH值成为了主要的驱动因素。 初古菌门(Korarchaeota)最初是在YNP黑曜岩池中发现的,但后来被发现广泛分布于其他地理上分离的陆地和海洋热环境中(图3)。从黑曜岩池沉积物建立的富集培养中纯化的初古菌门细胞的全基因组鸟枪测序(Whole-genome shotgun sequencing)结果得到一个完整的重组基因组‘Candidatus Korarchaeum cryptofilum’,这为深入研究这些分支较深的古细菌的生物学提供了初步的线索。
古细菌可能依赖肽发酵来获得碳和能量,但明显缺乏合成必需生物分子的(如嘌呤、辅助因子和辅酶a)的能力,表明其依赖于其他群落成员。最近深海热液沉积的宏基因组分析扩展了Korarchaeota的基因组表征。 曙古菌门(Aigarchaeota)首次发现于地下中等酸性的温泉丝状流质群落(图3)。第一个基因组‘Candidatus Caldiarchaeum subterraneum’的特征表明,其具有有氧氢氧化或一氧化碳氧化和潜在的碳固定能力。随后的宏基因组学和宏转录组学研究表明,在Octopus Spring(YNP)的“粉色丝状”藻群落中的曙古菌门是具有自养潜力的好氧化学有机养菌,而腾冲温泉沉积物中的曙古菌门基因组席(Genome bins)的分析表明,其具有为了节约资源的完全或兼性厌氧的生活方式和硫化物氧化能力。
生存于不同地热环境中的新细菌谱系的发现,恢复壮大了基因组组合,这些新细菌包括候选门Acetothermia,Fervidibacteria,Calescamantes,Atribacteria和Pyropristinus。Atribacteria广泛分布于各种厌氧环境中,该候选门包括OP9谱系及其姐妹谱系JS1。OP9谱系最初发现于YNP黑曜岩池,JS1谱系在富含甲烷的海洋沉积物中尤其丰富,是海底环境的一个特征类群。对Atribacteria的宏基因组和单细胞基因组的分析表明,Atribacteria是异养的厌氧菌,缺乏呼吸能力,发酵和共营养是它们共同的生理特征,表明它们在缺氧环境中的碳循环中发挥重要作用。在全球大量新微生物谱系宏基因组数据的调查中,Kryptonia在高温且pH接近中性(Circumneutral)的地热泉中发现。对其近完整的基因组的分析表明,这种异养生活方式具有独特的代谢途径和明显的营养缺陷,表明它参与了与其他群落成员(如Armatimonadetes)谱系的代谢且彼此间存在合作关系,这可能补充了Kryptonia缺失的代谢。
2.2 深海热液喷口
深海热液喷口的温度取决于喷口类型,扩散流喷口(仅高于环境温度几度,低于100℃)、白烟喷口(100~300℃)和黑烟喷口(高达400℃)。这些被还原的带热电荷的流体,当与含氧海水混合时,为微生物在热环境中的代谢提供了丰富的氧化剂和还原剂。环境调查研究了喷口场内部和喷口场之间不同的微生物群落(图2)。
尽管温度是微生物分布的一个重要决定因素,但直接受地质环境的影响的流体化学的变化决定了岩生生物可获得的能量,成为另一个关键的影响因素。镁铁质(玄武岩)中的低pH值、富金属和富硫化物热流体环境通常由硫呼吸和氢呼吸的ε-变形杆菌、产甲烷和硫酸盐还原的Euryarchaeota以及不可培养的SUP05/Arctic96BD-19ε-变形杆菌分支占优势,而相关的黑烟型烟囱则由ε-变形杆菌、Aquificales和深海热液喷口的广古菌门占优势。相比之下,在超镁铁质(橄榄岩)热液系统中,喷流富碱性、富氢和富甲烷流体,该领域的微生物还未被探索。
迄今为止,对少数已知的超镁铁质场所的基因标记研究记录了与镁铁质系统相对的不同微生物组合。在大西洋中脊的热液活动区,高温、活性碳酸盐烟囱内部缺氧的环境中,主要是甲烷八叠球菌目(Methanosarcinales),而更冷、含氧的外部则由更多样化的群落组成,包括硫氧化和甲烷氧化细菌和硫酸盐还原细菌。相比之下,来自该地点的高温生境的喷口流体中的主要微生物是热球菌目和未培养的泉古菌门类群。 纳米级超嗜热古菌(hyperthermophilic)‘Candidatus Nanoarchaeum equitans’和来自海洋热液喷口泉古菌中的燃球菌属(Ignicoccus sp.)共培养使纳古菌门(Nanoarchaeota)得以发现(图3)。对‘Candidatus Nanoarchaeum equitans’的基因组测序显示其基因组缩减(小于0.5Mb),是极紧凑的基因组,为信息处理和DNA修复机制编码,但缺乏氨基酸、核苷酸、脂类或辅助因子生物合成的基因,这意味着其具有专性共生方式的生活方式。
环境调查显示,纳古菌门还存在于其他极端环境中,包括海洋热液沉积物、陆地温泉和高盐生境。最近,来自单细胞基因组学的发展使有效的培养条件得以突破,使得从YNP的一个弱酸性温泉中分离出外共生纳米古菌‘Candidatus Nanopusillus acidilobi’及酸叶菌属(Acidilobus)宿主(一个泉古菌)的纯共培养成为可能。 对超级门Asgard【包括最初发现于洛基城堡热液喷口油田的Lokiarchaeota和Thorarchaeota,以及后续发现于多个地理分离地点(主要是地热环境)沉积物中的Odinarchaeota和Heimdallarchaeota】的宏基因组检测结果可为真核生物的形成过程提供了新的证据(图3)。
这些候选菌门包含真核生物最接近的古菌亲属,重组的基因组富含真核生物的特征蛋白,一些编码同源基因甚至可能参与膜运输、囊泡的生成、泛素和细胞骨架的形成,从而为真核生物宿主细胞存在于古菌中提供了有力的支持。最近,从深海海洋沉积物中获得了Asgard古菌的第一个分离株,与洛基古菌相关的‘Candidatus Nanopusillus acidilobi’菌株MK-D1,是真核生物基因研究中前所未有的发现。
2.3 冰冻圈
寒冷生态系统(温度低于5℃)非常多样化,当前的微生物生态学研究主要集中于冰冻圈中的冰川层和永久冻土层。从冰表层到冰下生态,不同的生态系统为大量的微生物细胞提供了不同生境。在融雪季节,具有较强次生色素沉着能力的藻类(如衣藻科和接合藻科)在光合作用活跃的冰上群落中具有生态优势。冰穴(Cryoconite holes)是冰上生境中微生物研究的热点,蓝藻是主要的初级生产者,其中颤藻属(Oscillatoria)、鞘丝藻属(Leptolyngbya)、席藻属(Phormidium)和念珠藻属(Nostoc)是研究最多的簇状菌属。
环境调查表明,全球范围内均有蓝藻的种类分布,并且在冰穴中细菌群落具有显著的时间变化特征。具体而言,融雪后自养蓝藻菌占主导地位,而异养鞘脂杆菌目(Sphingobacteriales)种群数量则是在季节过后大量增加。尽管在不同的地理区域(特别是极地和高山冰川)上有显著的差异,但冰层生境中也存在大量异养细菌的活动,这些菌群主要包括变形菌、放线菌门、拟杆菌门、绿弯菌门和浮霉菌门(图2)。
冰下环境具有不同的地球化学特征,主要包括基底冰、冰下水和饱和沉积物。但由于获取这些环境的样本具有的一定的困难,因此样本很少。这些未被充分研究的生境中的菌落主要以专性能自养的变形菌门群落为主。由于全球变暖和永久冻土融化引发的生态后果以及有关的原有微生物的活化,使得永久冻土受到了越来越多研究人员的关注。分子分析表明,极地冻土土壤中最丰富的细菌为绿弯菌门、变形菌门和放线菌门,它们的物种多样性和功能多样性普遍低于季节性冻融层。相比之下,山地多年冻土由于其极端空间变异和地温变异的特点,研究较少。最近一项对欧洲高山冻土的微生物多样性研究表明,该微生物群落富含超级门-髌骨细菌门,其中包括几个被预测会降低代谢能力的候选门,因此是一种外共生的生活方式(Ectosymbiotic lifestyle)。
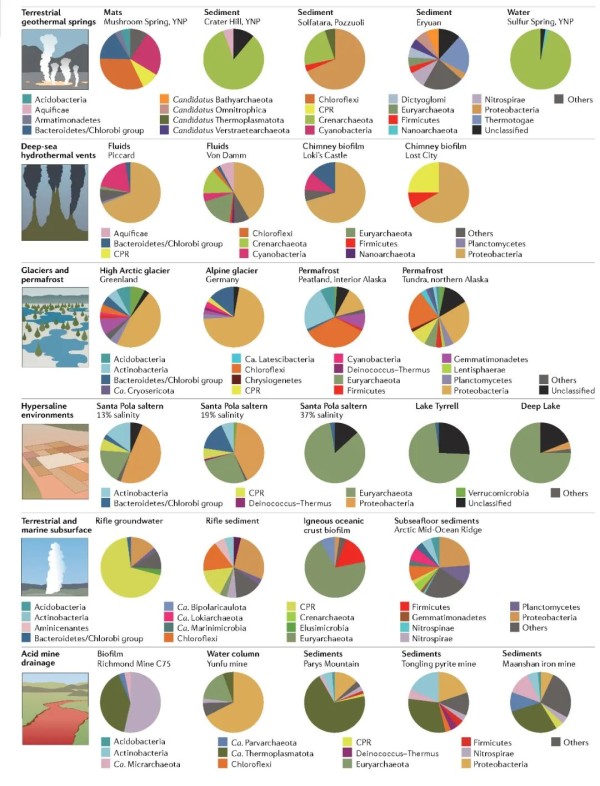
图2. 不同极端环境下的微生物群落组成。
细菌和古菌的相对丰度是基于具有核糖体蛋白S3(rpS3)标记基因支架的相对覆盖度(仅详细描述了相对丰度为1%或更高的那些)计算。原始读数下载于美国国家生物技术信息中心和美国能源部联合基因组研究所数据库,用Trimmomatic对数据进行质控并使用Megahit进行组装。使用CheckM对rpS3序列进行组装,并使用Bowtie2和SAMtools获取覆盖信息。CPR,候选门级辐射类群;YNP,黄石国家公园。每个栖息地的数据来源如下:为陆地地热泉(垫,沉积物和水流);深海热液喷口(流体和烟囱);冰川和多年冻土环境;高盐环境(圣波拉盐场,泰瑞尔湖和深湖);陆地和海洋地下(陆地地下水和沉积物,火成洋壳和海底沉积物);和酸性矿山排水(生物膜,水流和沉积物)(具体来源参照原文)。
2.4 高盐环境
对于高盐环境(例如盐湖和盐场),圣波拉盐场(西班牙阿利坎特)是一个值得关注的典型,它因具有全尺度的盐浓度而得到广泛的研究,关于它的研究揭示了群落结构在不同梯度下的急剧变化,在盐度最高的情况下古菌占有最大优势。具体来说,在饱和盐水中,原核生物多样性主要是以古菌Haloquadratum walsbyi和拟杆菌Salinibacter ruber占优势,在中等盐度条件下则观察到更多样化的细菌和古菌类群。泰瑞尔湖(维多利亚,澳大利亚)是一个海生盐湖(Thalassohaline salt lake),环境条件尤其是盐浓度受季节性变化的影响,因此是一个可与圣波拉盐场作对比的生境。
群落组成通常随时间和空间的变化而变化,离子浓度的季节性波动已经被证明是驱动微生物演替的因素。此外,在盐蒸发池中由于物理化学梯度,特别是光、氧和硫化物梯度,广泛的底栖微生物席高度分层。值得注意的是,对墨西哥格雷罗内格罗(Guerrero Negro)的高盐垫的剖面进行了广泛的16SrRNA基因测序,发现它们是目前已知的系统发育最多样化和最复杂的环境之一,发现了几个新的门水平细菌群和许多以前未检测到的低水平分类群。 对泰瑞尔湖地表水中提取的多个文库进行从头宏基因组组装,导致纳米盐古菌(Nanohaloarchaeota)在超门DPANN(所含第一个门的名称的首字母缩写)中发现。
这些超微但代谢多样的嗜盐菌广泛分布在全球高盐水生境,它们曾被认为是自养型,但南极纳盐古菌菌株的共培养研究则证明这些嗜盐古菌对宿主具有依赖性。同时,单细胞基因组学能够解决候选细菌门KB1的系统地理学、渗透胁迫适应和代谢潜力问题。高盐碱湖沉积物的广泛宏基因组测序恢复了871个基因组席,包括候选门级辐射类群(CPR)的成员,其中有几个是原位最占优势的类群,这些丰富的CPR生物可能作为发酵剂在初级碳降解中发挥作用。
2.5 地下环境
深层地下环境可操作性地定义为持续存在于地面或海底以下至少1米的环境。海洋地下沉积物是地球生物圈的主要组成部分。尽管受到严重的能量限制,微生物仍可持续潜到海底深处,而且它们的长期代谢活动可能在全球生物地球化学循环中起着基础作用。
环境调查揭示了大量来自典型“海洋深层生物圈”的未培养的微生物,它们在地理和地球化学不同的地点的群落组成中占据很大的一部分(图2)。这些常见的谱系包括暗黑菌门、绿弯菌门以及古细菌内优势门相关的新的系统发育谱系,如奇古菌门(Thaumarchaeota)(特别是海洋I群)、深古菌门、洛基古菌和海洋底栖古菌E群。海洋下微生物的垂直分布模式已经有很好的研究和记录,揭示了物种丰富度会随沉积物深度或年龄的增大而降低,以及普遍存在的广泛分类群的优势种群也会随之有着显著的分层。这种群落组成的变化已被证明是由能量的可用性降低引起的,由此引发微生物活性和丰度的下降,这同环境条件的变化有关。火成的海洋地壳蕴藏着地球上最大的蓄水层,尽管取样和原位实验技术不断进步,但在这种地下生境中探索微生物仍然具有很高的挑战性。开拓性的研究已经揭示了本地微生物的组合,这些组合与居住在附近和相关环境中的微生物(例如,热液流体和羽流,以及深海水)截然不同。
这种差异很大程度上是由细菌分支驱动的,尤其是厚壁菌门,这似乎是这个难以接近的系统所特有的。与此同时,最近的一项研究首次探索了埋藏在岩石化的下海洋地壳(占地壳体积的三分之二)中的微生物群,揭示了其分布不均并具有应对低营养和波动的地下条件的异养型、超低生物量需求的群落。 陆表以下也是地球原核生物的主要聚集地。然而,由于可接近性差,对这一地下的微生物多样性的探索程度仍然相对不足。
环境调查记录了各种地质环境中多样的微生物群落,这些地质环境尽管普遍存在营养和能源匮乏的情况,如深层原始含水层、火成岩和变质岩等。最近,一份来自全球大陆地下地区的细胞浓度和微生物多样性数据汇编发现,细菌在数量上比古菌更丰富,其中,细菌群落以变形菌门为主,古菌群落以甲烷微菌奇古菌门为主。虽然没有确定预测物种丰富度可靠的因子,但发现群落组成和样品岩性之间具有统计学上显著的相关性。同时有一些类似的研究,随着环境变量(包括温度和地球化学成分)或沿着陆地地下深度样带的变化所引起的群落组成的变化。
宏基因组学研究发现,在地表下,特别在陆地地区,存在着大量以前未知的细菌和古菌。在众多候选或很少被研究的门中,特别令人感兴趣的是那些与CPR和DPANN有关的门,目前许多可用的基因组是从美国Rifle附近科罗拉多河的含水层重建的(图3),对CPR细菌的第一批基因组的分析表明,超小细胞在碳和氢循环中起作用并具有阻止其培养的代谢限制。随后对完整和分散的CPR基因组的大规模重组表明这些生物与其他细菌的区别:小基因组(通常小于1Mb)、大多缺乏大量的生物合成途径(即,不完整的三羧酸循环和核苷酸和氨基酸生物合成途径,缺乏电子传递链复合物,因此表明代谢依赖于其他群落成员)、自剪接内含子和编码在其rRNA基因中的蛋白质(这一特征在细菌中很少发生),以及不寻常的核糖体组成(所有缺失的核糖体蛋白L30和特定的谱系缺失的核糖体蛋白L9和生物发生因子GTPase Der),这些特征表明这是细菌领域内一个独特的细分。
与此同时,从这个地下位点回收的基因组席极大地扩大了该领域古菌基因组的取样范围:具有小基因组的主要辐射、新的蛋白质组组成和强相互依赖性(DPANN13),这些发现与CPR细菌的发现类似。根据为这些神秘古细菌重建的第一个完整基因组,可以有把握地预测不完整或缺失的途径。
2.6 酸性矿井排水(AMD)
AMD环境中的微生物物种丰富度受到逆境的限制,特别是低pH、高水平的有毒金属和有限的电子供体和受体范围的限制。由于这些嗜酸组合在AMD和工业生物采矿(Biomining)过程中具有潜在应用价值而受到广泛的研究。AMD群落主要由变形菌门、硝化螺旋菌纲(Nitrospira)和广古菌门(Euryarchaeota)组成,其中包括研究最广泛的铁氧化剂/硫氧化剂硫杆菌属(Acidithiobacillus spp.)和钩端螺菌属(Leptospirillum spp.),它们在氧化硫化物矿物溶解中起重要作用,以及鲜为人知的铁氧化剂Ferrovum spp.,它们在中等酸性条件下富集。
AMD生态系统中生长的生物膜通常具有非常低的多样性,因此是研究自然环境中生态过程的理想目标。美国铁山里士满矿的化学自养生物膜通常由一或两种铁氧化自养细菌占主导,例如,钩端螺旋体II组(图2)。细菌、古菌和真核生物的非优势异养和混合营养种群也可能根据生物膜发育阶段或取样空间的不同而具有不同的丰度。AMD生态系统在地球化学条件上经常有着巨大的时空变化,先前的调查显示在里士满矿中,古菌相对丰度的显著波动与pH和电导率的季节性变化有关。最近,一项研究调查了中国东南部和全球各地具有地球化学多样性的AMD地点的微生物生态分布。
结果表明,无论地理位置隔离程度如何,pH值都是影响群落结构的主要因素。有趣的是,这种依赖于pH值的模式在局部范围也很明显,这在随后对一个大规模和高度异质性的尾矿场(Tailings)的多样性调查中也得到了证明。 里士满矿山低复杂度AMD生物膜代表了最初通过宏组学方法探索的天然微生物群落。广泛的Sanger宏基因组测序使得超小古菌谱系ARMAN(里士满矿嗜酸纳米古菌)—小古菌门(Parvarchaeota)和Microarchaeota的发现(图3)。这种复合基因组具有异常高的编码密度,并且含有大量未知生物学功能的基因。随后对全球分布的包含类ARMAN生物体的宏基因组数据集进行了分析,表明它们在AMD和温泉环境中普遍存在,以及它们在原位碳、氮和铁循环存在潜在参与。
最近,一项研究报道了将一种类似ARMAN的生物体‘Candidatus Mancarchaeum acidiphilum’Mia14与英国帕瑞山的硫化物矿石中的Cuniculiplasma divulgatum PM4(热原体纲)共培养。深度基因组测序能够组装高度富集的Mia14群体的完整基因组,这表明中枢代谢途径中存在严重的空隙(例如,缺乏用于核苷酸和许多氨基酸生物合成的最小酶组,并且维生素和辅助因子的合成途径不完整),表明是寄主依赖型的生活方式。
2.7 其他极端环境
苏打湖含有高浓度的碳酸钠,是地球上主要的自然碱性环境。在这些独特的水生生态系统中,嗜盐嗜碱微生物群会面临高pH(9.0 - 12.0)和盐度(达到饱和浓度)相关的多重胁迫。基因调查显示盐浓度可能是决定微生物多样性和分布的主要因素。而低盐度和中盐度湖泊包含相对多样的微生物群落,以α-变形菌纲(主要为红杆菌科)和γ-变形菌纲(如Halomonas和Thioalkalivibrio)为主,高盐盐湖的微生物种群与高盐盐田中盐水的微生物种群相似,并表现出低多样性和极端嗜盐盐细菌占优势的特征。 干旱生态系统约占全球陆地表面的41%,特别容易受到气候变化和土地退化的影响。干旱度用降水量与潜在蒸发蒸腾量(evapotranspiration)之比来衡量,在塑造全球旱地土壤微生物群落的多样性和组成方面起着主导作用。
具体而言,干旱程度增加后通过减少植被和土壤有机碳的含量来显著降低微生物的多样性和丰度。尽管存在多种极端条件,但干旱土壤中仍存在多种细菌谱系,如放线菌门、绿弯菌门、厚壁菌门、芽单胞菌门和变形菌门。
低温和高压主导着的黑暗海洋环境(在光带之下),是地球上最大的微生物水生栖息地。原核细胞丰度随水柱深度的增加而减少。基因标记研究和宏基因组分析表明深海微生物群落具有深度依赖模式,海洋最深水域微生物的多样性增加。驱动这种多样性趋势的因素在很大程度上尚不清楚,但深水循环和底栖生物过程被认为在其中发挥着作用。深海细菌群落主要由变形菌门(α-变形菌纲,γ-变形菌纲和δ-变形菌纲)、绿弯菌门和放线菌门占优势,而古菌群落以海洋I群泉古菌门为优势菌群。
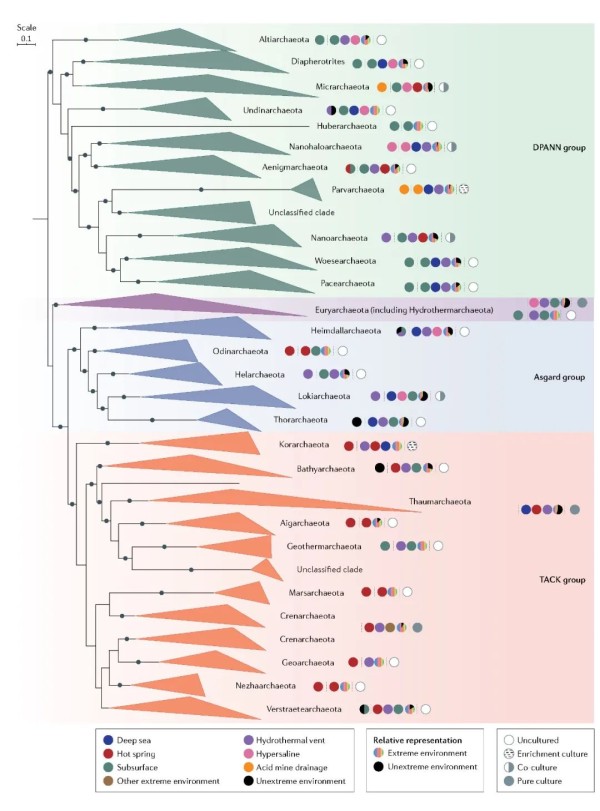
图3. 古生菌域的基因组树显示了目前提出的主要谱系(门)。
美国国家生物技术信息中心(NCBI)数据库GenBank(2021年2月23日)中的所有古细菌基因组(宏基因组组装,单组装和分离组装的基因组)均已下载并使用dRep进行冗余分析(版本3.2.0;参数'-comp 80-con 5'选择完整性超过80%且污染少于5%的基因组)。对于纳古菌门,Pacearchaeota,Huberarchaea和Hydrothermarchaeota,由于没有相关的基因组符合此标准,阈值较低('-comp 70-con 5')为了减少计算量并简化说明,只选择了已建立好的泉古菌门和Euryarchaeota代表性基因组的两个主要分枝。在系统发育基因组分析中共包括553个基因组。
该树是根据122个古细菌的连锁比对使用IQtree 2.1.2版进行1000次超快自举迭代的特异性保守标记基因。通过贝叶斯信息准则确定最佳拟合LG+F+R10模型。使用GTDB-Tk生成级联比对。支持值为70%或更高显示为黑色圆圈。比例条表示每个位点的替换次数。彩色圆圈显示了根据来自宏基因组或单个基因组的基因组描述的每个新的潜在门级组进行第一次基因组取样的环境细胞(最左边),与NCBI数据库中当前可用的每个门相关的所有基因组的栖息地分布(中间;在三个极端环境中,大多数基因组被检索到,饼状图显示从极端环境与非极端环境中检索到的基因组的相对丰度),当下的培养现状(未培养,富集培养,共培养和纯培养)(1)对于Huberarchaeota和Hydrothermarchaeota等一些门,目前可用的基因组仅限于一个或两个极端环境,(2)对于Helarchaeota和曙古菌门,只有少数基因组(少于10个)可用,(3)用于发现Geoarchaeota的温泉宏基因组组装基因组仅保存在美国能源部联合基因组研究所数据库GOLD中。
重要的是,几乎所有提出的古菌门最初都是通过分子方法在各种极端环境中发现的(16S核糖体RNA基因研究,特别是最近的宏基因组学或单细胞测序),或者如泉古菌门,通过培养获得。DPANN,是超级门(Diapherotrites,Parvarchaeota,Aenigmarchaeota,Nanoarchaeota和Nanohaloarchaeota)。
3 群落的功能和动态
大多数未培养的微生物限制了我们分析时空格局下微生物群落结构基础生理生态的能力。宏基因组无需培养,可以直接从环境中恢复基因组、转录和表达的基因信息,具有深入了解所有群落成员的功能和生态作用的意义。
总体而言,极端环境群落的多组学研究揭示了参与能源节约、碳固定和氮代谢以及抵抗极端环境胁迫的优势基因家族。与此同时,比较组学分析已被应用与分析地理上分离的微生物群落,并用于探索不同时空尺度不同环境梯度下微生物群落的功能及动态变化。这些研究已经确定了群落或分类单元和环境变量之间有趣的联系,这有助于理解不同的微生物分布模式。 一些研究报告了YNP中微生物群落的宏基因组分析,这些微生物群落在地球化学上具有明显的地热特征。
重建了优势成员(包括一些新的、以前未检测到的谱系)的基因组,解析了其代谢潜力和策略,以及与环境特征和原位地球化学过程存在的潜在联系。Bison Pool碱性泉流出口沿线嗜热生物膜的比较宏基因组学表明,微生物群落从池中的化学营养群落(92°C)过渡到外围群落(56°C)的光营养群落,同时伴随着与环境条件和能量可用性变化相关的群落结构和代谢功能的急剧变化(图4)。
另外两项研究使用了宏转录组学方法来分析碱性硅质Mushroom Spring的光营养微生物席的时间序列(在一个Diel cycle中)。原位基因转录模式,特别是与光合作用相关的基因转录模式,揭示了占主要优势的光养生物通过采取不同的策略来最大限度地捕获和利用太阳能,并证明了丝状无氧光合营养体如何在基因转录水平上响应不断变化的环境条件。
冰冻圈的组学研究主要集中在冻土上,特别是人为解冻或沿自然融化梯度的群落动态。 对阿拉斯加7天内冻土解冻的微生物群落的宏基因组分析表明,群落组成和功能反应强烈,特别是与碳和氮循环相关的基因和代谢途径的变化。多组学已被应用于探索不同解冻状态下的土壤微生物组合的变化,如完整的冻土、季节性冻融层和热岩溶沼泽。在分析的土壤中,最活跃的群落成员之间存在显著差异,优势微生物蛋白也发生了显著变化(图4)。具体来说,永久冻土层中冷休克蛋白的表达相对较高,转运蛋白的表达较低,在沼泽土壤中涉及耐冷和其他胁迫反应的蛋白较少。总之,这些研究揭示了组学数据与过程测量之间的良好联系,揭示了在低温条件下生存的新适应策略,并为改进气候变化情景下冻土融化过程中温室气体排放的模型预测提供了重要信息。 圣波拉盐沼微生物群落的宏基因组分析,揭示了沿盐度梯度下的生态变化(图4)。
具体来说,比较代谢组学已经表明中等盐度下微生物群落相对较多,而在氯化钠饱和下高嗜盐菌H. walsbyi和S. ruber占优势。相应地,对微生物蛋白等电点分布(指示嗜盐适应)的分析表明,随着盐度的增加,“盐入”策略取代了“盐出”策略。此外,在圣波拉宏基因组中,光异养生活方式(注意,光在极端高盐环境中广泛被作为能量来源)的质子泵的分析表明,细菌视紫红质增加,感觉视紫红质和卤视紫红质水平以及蛋白质视紫红质水平沿盐度梯度下降。另外还对居住在南美洲阿塔卡马沙漠(盐岩)的嗜盐微生物群落的时间序列样本的宏基因组分析显示,比较宏基因组学揭示了罕见降雨事件后群落的独特动态:初始反应是快速变化,恢复过程中则表现为更渐进的调整。
尽管最近的研究表明,地表下的环境是生物多样性分布的热点区,拥有许多以前未知的古菌和细菌谱系,但群落功能(特别是这些未培养的类群的代谢能力)如何随深度变化仍几乎没有被探索。迄今为止,一项基于标记基因转录本的研究揭示了德国中部两个(上、下)重叠的原始石灰岩含水层中活性微生物群落具有不同的群落结构。值得注意的是,Sulfuricella和Nitrosomona在群落中占据很大优势,并具有通过编码Calvin–Benson–Bassham循环来固定碳的能力,其能量可能来自还原硫和氮化合物的氧化。另一项研究使用基因组解析宏基因组学和单细胞基因组学来证明群落组成和功能的主要变化,对美国二氧化碳驱动的结晶间歇泉(Crystal Geyser)随着地下相对水源深度的变化,不同碳固定途径的相对重要性进行了分析。CPR细菌(代表生态系统中最多样化的生物)以及DPANN和其它细分支古菌在更深的含水层中显著富集。这些代谢能力有限的超小型微生物相互依存的生活方式和代谢合作可能使其能够适应长期营养限制的地下环境条件。
组学研究对AMD及其相关环境中微生物组合的时空特征进行了表征。对地理上分离的AMD群落进行整合的宏基因组学和宏转录组学研究,揭示了与场地地球化学特征密切相关的基因转录谱。里士满矿山内的AMD位点的嗜酸生物膜的蛋白质组学研究显示,群落中丰度最大的细菌(钩端螺旋体组II)的蛋白质表达对群落组成的响应更显著,而丰度较低的细菌的蛋白质表达在很大程度上受到非生物因素的影响(例如,pH值和温度)。同时,通过对不同酸化阶段的尾矿微生物群落和AMD生物膜生态演替阶段的比较分析,发现其功能谱发生了明显的时间变化。早期和晚期阶段的微生物群落具有不同的适应低pH和重金属的基因,在里士满矿生物膜群落的生态演替过程中,优势种钩端螺旋体组II的生理变化得到了明显的证明,表明了其对不同胁迫的响应。另外宏蛋白质组学研究还调查了嗜酸生物膜生物对不同pH条件和温度的反应。结果揭示了低丰度分类群的pH依赖生态位分化和pH诱导的优势物种特定功能类别的变化,以及表达蛋白水平的温度响应对个体、整个群落和特定功能的影响。
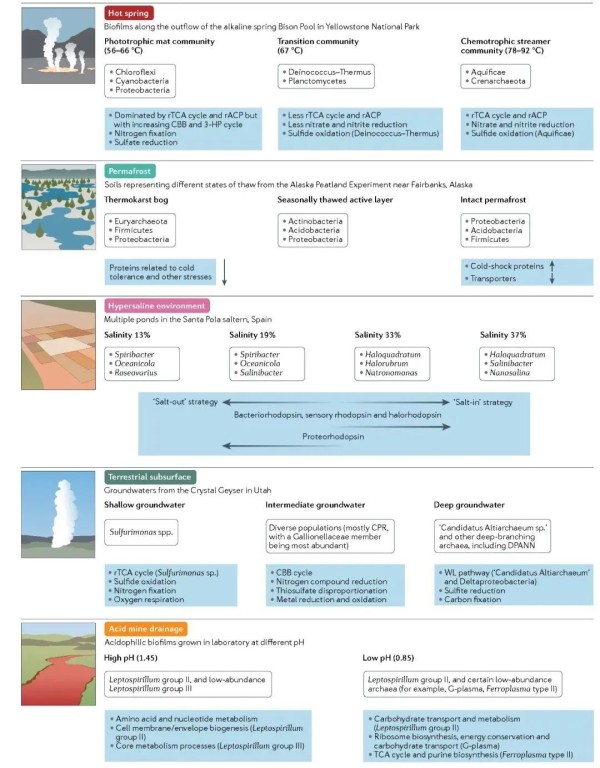
图4. 微生物群落沿特定环境梯度的组成和功能变化。
总结了各类型极端环境下具有代表性的元组学研究结果。显示了群落中丰富的分类单元(门、属、种/基因型),主要或过度的代表行功能过程和相关途径,以及主要的适应策略。垂直小箭头(永久冻土)表示宏蛋白质组学数据中特定蛋白质表达(相对于其他两种土壤)的高低,水平的大箭头(高盐环境)表明沿盐度梯度的宏基因组中特定适应策略的相对优势或与特定质子泵相关的序列数量的增加。CBB,Calvin–Benson–Bassham;CPR,候选门级辐射类群;DPANN,是超级门(Diapherotrites,Parvarchaeota,Aenigmarchaeota,Nanoarchaeota和Nanohaloarchaeota);3-HP,3-羟基丙酸酯;rTCA,反向三羧酸;rACP,还原性乙酰辅酶A途径;TCA,三羧酸;WL,Wood–Ljungdahl。每个环境数据来源参考原文。
4 极端环境中微生物的进化
一个基本的问题是微生物如何进化和专性化,去适应极端和一些高度变化的环境条件。这个问题通过模式生物的基因组和生理学研究得到了初步解决。多位点序列分型(Multilocus sequence typing)和菌株基因组的比较分析允许检查遗传变异和潜在过程的模式,以及它们在自然群体中的功能意义。
重组作为定义进化过程的重要参数,在嗜盐和嗜热古菌中得到了广泛的使用。研究表明,Halobacterium sp. AUS1和Sulfolobus islandicus种群频繁重组。在Haloferax属的不同物种之间甚至发现了高重组频率的染色体长片段交换,这表明嗜盐古菌中的重组屏障比细菌中更多。水平基因转移(HGT)是原核基因组中基因获得的主要来源,并假定基因含量的变化是微生物适应性进化的主要模式。已经发现该过程在嗜盐细菌、古菌和硫化叶菌中特别普遍。具体而言,比较基因组学揭示了HGT在S. ruber和haloarchaea之间的收敛和基因交换,这些模块化的适应元件对S. ruber的盐适应、能量学和光生物学有重要影响。
对极端环境中相对较低复杂度的组合进行直接鸟枪式基因组测序,可以在原位检测种群水平和全基因组的异质性。 具体而言,群体基因组学分析显示,在里士满矿山AMD生物膜中优势类群钩端螺旋体II组密切相关的自然种群同个体之间未发现基因含量有病毒介导的和质粒介导的高变异性类群有着大规模的同源重组。菌株分解的群落蛋白质组学进一步揭示了杂交基因型在时空分布上的差异及其在生物膜发育不同阶段的优势,这表明重组是适应大尺度环境的重要过程或是一种独特的生态策略。
此外,极端环境下微生物的种群宏基因组分析使得测量野生种群的进化速率成为可能,但对测量自然微生物组合中的单个物种来说仍具有挑战。研究显示,在缺氧海底沉积物中,要么AMD生物膜中天然钩端螺旋体III组种群的核苷酸替换率异常高,要么群落中四个优势谱系种群的突变率极低。 极端环境为研究特定古菌谱系的起源和进化提供了极好的机会。奇古菌门在自然界普遍存在,在全球氮循环中发挥着关键作用。奇古菌门及其姐妹谱系曙古菌门之间有着难以捉摸的进化关系,最近通过比较基因组学从温泉沉积物中检索出新的曙古菌门基因组席得到了解决。发现这两个门可能起源于热环境,并共享大量的基因。后来奇古菌门入侵了广泛的非热环境,导致这两个主要古菌群之间的功能分化。以饱和盐水环境为主要生境的古菌通常包括盐古菌和主要依赖氢的产甲烷菌。系统发育和系统发育分析表明,盐古菌的祖先可能来自产甲烷菌。
随后的比较基因组学表明,这种生理上的剧烈转变(从厌氧化能自养生物到需氧异养生物)是通过(通过HGT)从细菌获得大量基因而实现的。最近对一种新型的极端嗜盐产甲烷菌群‘Candidatus Methanonatronarchaeia’(SA1-古菌)的富集和基因组特征进行了研究,其基底分支为盐古菌,并居住在高盐湖中,为盐古菌的早期进化提供了进一步的认识。值得注意的是,对高盐环境的适应能力可能在盐古菌和‘Ca. Methanonatronarchaeia’分化之前就已经发展。进化基因组学研究表明,尽管两种菌系都采用“盐入”策略,但‘Ca. Methanonatronarchaeia’主要通过基因丢失进化,而盐生古菌则通过基因获得进行基因组进化。 最近从CPR细菌和DPANN古菌重组基因组提出了一个问题,即这些主要新谱系的明显分组是快速进化的产物还是早期分歧的反映。到目前为止,已经预测CPR和DPANN的代谢差异很大。尽管其中很多缺乏与其小细胞和基因组大小一致的许多生物合成能力,如Altiarchaeota,具有足以支持自由生活方式的代谢潜力。
因此,基因丢失和基因组减少,细菌转变为宿主相关生活方式的特征,可能是推动某些CPR和DPANN谱系快速进化的重要能力,导致它们在系统发育树中新谱系的出现。DPANN古菌也显示了可能导致进化速率提高的其他特征:纳古菌门(Nanoarchaeota)、Pacearchaeota和Woesearchaeota中多样性产生因素的普遍存在以及ARMAN编码的CRISPR-Cas9系统。同时,也有证据表明CPR和DPANN起源于可能是小基因组生物很早期的进化。例如,CPR和DPANN生物似乎完全是厌氧菌,这与早期地球上的可能代谢一致。此外,II/III样和III样核酮糖1,5-二磷酸羧化酶/加氧酶(Rubisco)广泛分布于一些CPR和DPANN生物体内,它们参与古老异养的核苷酸基础途径。在广泛不同的群体中存在着特定的基因可能意味着许多现代群体丧失了祖先有机体的特征。 自然群落的不同类群可能受到不同的选择压力,并采取不同的进化策略。因此,少数特定类群的研究结果可能不能直接推广到整个环境。为此,已有几项研究试图从群落的角度研究进化过程,并提供补充见解。
例如,对热液活动区的碳酸盐烟囱生物膜宏基因组的分析显示,转座酶基因的丰度和多样性非常高,表明在物种丰富度低的群落中,出现大量的水平基因转移。这种频繁的基因交换可能产生多样性的表型以及对极端多变的环境条件的适应。另一项研究使用基因组解析宏基因组学来解析群落中种群内部和种群之间的精细基因组变异的模式,表明在两个地球化学性质不同的热液喷口区域中,形成不同类群的微生物种群的进化过程是不同的。
结语
几十年的多样性调查已经全面揭示了生存在地球主要极端环境中的微生物系统发育的广度。最近对易获取的生态系统(如温泉和AMD)的广泛采样和高通量16S rRNA测序进一步对其大规模生态分布的模式及其可控性有了了解。有趣的是,定义一种特定类型的极端环境的主要参数(例如AMD的pH值和高盐生境的盐浓度)似乎是影响群落形成的主要因素。通常情况下,环境变得极端,微生物多样性就会下降,仅少数类群占据优势。尽管最近的研究试图预测这些多样性模式(BOX3),但解决它们的本质及潜在的生态和进化过程是微生物生态学新出现的关键性挑战。 在极端环境中加速重建和表征主要新群体的微生物基因组,大大改变了系统发育树的结构,彻底改变了我们对古菌和细菌的理解。
值得注意的是,尽管地球上的大多数环境中都有古菌的存在,但古菌系统发育树中的新谱系主要来自对各种极端环境基因组的探索(图3)。这突出了这些生境是微生物“暗物质”的宝库以及对理解微生物生态学和早期地球生命的模型系统具有重要意义。鉴于不同类型的极端环境之间的研究强度极不平衡,以及在较低的分类水平上发现新的类别和群体有着巨大的空间,继续对这一未培养群体的多样性和代谢能力进行基因组探索将是该领域的一个主要的主题。这些研究很重要,应该伴随着有针对性的培养和功能验证工作,因为有证据显示,这些未开发的谱系虽然相对丰度较低,但可能在群落中发挥着关键的作用,或能够在特定环境条件下获得生态优势。
一般来说,微生物生态学发展的主要限制是天然微生物组合中的真核生物和病毒。真核生物和病毒执行许多关键的生态系统功能并在塑造原核生物种群动态中起关键作用,但这些微生物特别难以培养并且难以通过基因组方法研究。极端环境的性质和独特性可能为这些鲜为人知的群落成员的生态和进化分析提供了巨大的机会。病毒在许多极端环境下的微生物食物网中发挥着特别重要的作用,而组学方法和技术的进步才刚刚开始揭开这些生境中病毒的神秘面纱。研究揭示了病毒多样性高,病毒种群的季节性演替和地理分布发现了以前未被认识到生态作用的新的病毒(例如,南极水生系统中的病毒噬菌体和来自温泉、高盐和地下环境的巨大噬菌体分支),并阐明了病毒如何与特定宿主相互作用并推动群落动态。同时,极端环境中真核生物的组学分析相对较少。
值得注意的是,宏基因组学已经能够从里士满矿区真菌主导的AMD丝状生物膜中接近完整地重组丝状真菌的基因组,从而能够评估(使用转录组学和蛋白质组学)其在不同环境中的代谢分化。另一项宏组学分析显示印度洋亚特兰提斯岸辉长岩地块深部岩化地壳中低多样性但可分析的真菌群落。原则上,这些新的成果以及未来对微生物群落的病毒和真核生物探索的努力,将有助于解决极端环境中所有营养层次的复杂相互作用,这些相互作用最终塑造了整个群落的结构和动态。这样的组学数据可以被纳入预测模型,用于预测自然环境中的群落组成和功能。
当我们努力丰富我们对极端环境中的微生物过程和相互作用的认知时,一个基本的问题是,在这些瞩目的模型系统(BOX2)中推断出的生态原则是否可以预测其他受限制较少的生态系统的模式。这是很重要的,因为使这些模型复杂性降低的许多特性使它们与大多数其他环境相区分。然而,没有一个模型系统可以捕捉其他系统的所有特征,最近的研究已经证明简化的模型微生物群是操纵复杂性和推进我们对复杂自然群落的认识的有效工具。更重要的是,如确定性的群落组合、微生物生物地理模式的特定生态驱动(例如,温度、pH和盐度)和塑造群体基因组变异的进化过程,已经在其他曾经未明确的系统中得到类似证明。因此,对极端环境下微生物生态学和进化的综合研究,将进一步加深我们对更复杂的自然微生物群落和全球生态系统的理解。
Box 3. 模拟极端环境中的微生物群。
在时空尺度上定量预测微生物群落组成和功能属性,可以弥补未知和未来群落状态的缺口,从而更全面地了解微生物与生物和非生物环境之间的相互作用。开发和实施预测的主要障碍与用于构建模型材料的有限性(即观测数据)和潜在因素的复杂性有关。另一个障碍是,很少有被广泛接受的定量工具能用来作出准确的预测。尽管如此,近年来在高通量DNA测序和生物信息学工具方面的进展使我们能够理解微生物群落和功能是如何在空间和时间中构建的,以及它们在环境变化中是如何变化的。相对较低的复杂性组合以及清晰的微生物分布模式和驱动因素有助于预测极端环境下的群落动态。例如,基于模型的方法最近被应用于预测特定的岩盐相关古菌群的生物地理起源,以及地球化学多样性的酸性矿井排水环境中微生物组合的分类和功能结构。进一步努力将有助于推动微生物组研究领域超越简单的联想和描述性分析。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
网址:重磅综述 https://www.yuejiaxmz.com/news/view/509339
相关内容
JAMA年度重磅!全面综述高血压治疗最新进展柳叶刀重磅综述:成人肥胖症的现代医学疗法
NEJM重磅综述:生物钟和疾病
Cell重磅综述:定义长寿饮食,优化人类寿命
重磅来袭
Cell发布衰老领域重磅综述:创造性提出衰老的十二个标志
综述
JAMA综述:对肥胖患者的评估及生活方式管理(上)
Nature拳头综述(IF=71)
优化算法综述

