写出下列反应的热化学方程式.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol2H2O2(l)=2H2O(l)+O2(g) ΔH=
马桶堵塞:可用马桶塞通,或者倒入热水和醋混合的溶液,静置后用热水冲下。 #生活知识# #家居维修#
能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3[Cu(NH3)3]Ac•CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g)CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)
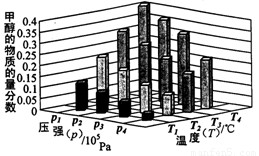
A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g)CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
网址:写出下列反应的热化学方程式.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol2H2O2(l)=2H2O(l)+O2(g) ΔH= https://www.yuejiaxmz.com/news/view/562437
相关内容
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol肼是一种高效清洁的火箭燃料.0.25 mol N2H4(g)完全燃烧生成氮气和气态水时.放出133.5 kJ热量.则下列热化学方程式中正确的是A. N2H4(g)+O2(g)===N2 ΔH=+267 kJ·mol
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.(1)在定向爆破中.常利用氧化铁与铝反应放出的热量来切割钢筋.该反应的化学方程式为__.(2)已知:2Fe2O3=3CO2 △H=+468.2 kJ·mol
二氧化碳的回收利用是环保和能源领域研究的热点课题.(1)新的研究表明.利用太阳能可以将CO2分解制取炭黑.其原理如右图所示.该过程的能量转化形式为 .在整个过程中.FeO的作用是 .已知:①2Fe2O4 ΔH=akJ/mol②C ΔH=bKJ/mol 则过程2的热化学方程式为 .(2)一定温度下.在密闭容器中进行反应CO22CO ΔH>0 题目和参考答案——青夏教育精英家教网——
金属单质及其化合物与工农业生产.日常生活有密切的联系.请回答下列问题:(1)一定温度下.氧化铁可以与一氧化碳发生如下反应:Fe2O3+3CO2(g).△H=QkJ?mol
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
N2H4是一种高效清洁的火箭燃料.0.25 mol N2H4(g)完全燃烧生成氮气和气态水时.放出133.5 kJ热量.则下列热化学方程式的书写正确的是A.N2H4(g)+O2(g)====N2 (g)+ H2O (g),ΔH=
科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH
N2H4是一种高效清洁的火箭燃料.0.25 mol N2H4(g)完全燃烧生成氮气和气态水时.放出133.5 kJ热量.则下列热化学方程式中正确的是A.1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g) ΔH=+267 kJ·mol

