氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[A
发布时间:2025-01-18 05:05
酸雨是由于空气中的二氧化硫和氮氧化物与雨水反应形成的。 #生活知识# #科学#
氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr.回答下列问题:
(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为
4d105s1
4d105s1
。(2)下列关于物质结构与性质的说法,正确的是
BC
BC
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于Mg,但其第二电离能却远大于Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为
四面体
四面体
,中心原子S的杂化方式为sp3
sp3
。[Ag(S2O3)2]3-中存在的化学键有BCE
BCE
(填字母序号)A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ•mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
元素 Al Si P S Cl E1(kJ•mol-1) 42.5 134 72.0 200 349 表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
P的价电子排布式为3s23p3,3p能级处于半充满状态,相对稳定,不易结合一个电子
P的价电子排布式为3s23p3,3p能级处于半充满状态,相对稳定,不易结合一个电子
。(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为
Fe3O4
Fe3O4
;已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则密度ρ为g•cm-3(用含a和NA的代数式表示)。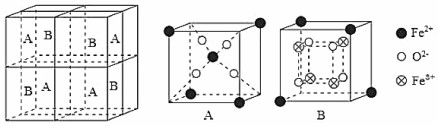
【答案】4d105s1;BC;四面体;sp3;BCE;P的价电子排布式为3s23p3,3p能级处于半充满状态,相对稳定,不易结合一个电子;Fe3O4;
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/4/20 14:35:0组卷:105引用:2难度:0.3
相似题
 1.碳及其化合物有着重要用途。回答下列问题:
1.碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为。
(2)在CH2=CHCN中,碳原子的杂化方式有、,所含σ键数目和π键数目之比为。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是。
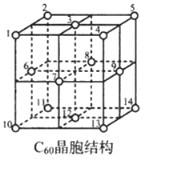
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20Å (1Å=10-8cm),则C60的晶体密度为g/cm3。
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为 Å。
发布:2025/1/5 8:0:1组卷:53引用:2难度:0.4
 2.铁及其化合物在生产生活及科学研究方面应用非常广泛。
2.铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为;其最外层电子的电子云形状为。
(2)(NH4)2Fe(SO4)2•6H2O俗称摩尔盐
①NH4+电子式为。
②N、O两元素的第一电离能由大到小的顺序为(用元素符号表示)
③SO42-中S原子的杂化方式为,VSEPR模型名称为。
(3)K3[Fe(CN)6]晶体中中心原子的配位数为;晶体的配位体为(用化学符号表示)
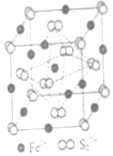
(4)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为g•cm-3
发布:2025/1/5 8:0:1组卷:7引用:1难度:0.7
3.N、P、As都是ⅤA族元素,且原子序数依次增大,它们的单质和化合物在生产、生活中有广泛应用。请回答下列相关问题。
(1)基态磷原子的价电子排布式为。
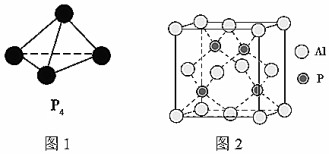
(2)已知白磷的分子式为P4,其结构如图1所示。科学家目前合成了N4分子,其分子结构与白磷类似。则N原子的杂化轨道类型是,N-N-N键的键角为。
(3)硝酸的沸点较低,从氢键的角度推断其可能的原因是;请写出两种与NO3-互为等电子体的微粒化学式(请写一个分子和一个离子)。
(4)NO2-与钴形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图2所示。磷化铝中,Al原子的配位数为,若最近两个Al原子之间的距离为acm,用NA表示阿伏加德罗常数的值,则该晶体的密度为g•cm-3(用含有以上字母的计算式表示)。
发布:2025/1/5 8:0:1组卷:55引用:1难度:0.5

把好题分享给你的好友吧~~
网址:氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[A https://www.yuejiaxmz.com/news/view/728876
下一篇:铁及其化合物在日常生活、生产中应
相关内容
硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol15.亚硫酸钠在空气中易被氧化生成硫酸钠.现有ag亚硫酸钠样品.溶解后加入足量氯化钡溶液.可得干燥沉淀bg. (1)若亚硫酸钠未被氧化.b= a. (2)若亚硫酸钠全被氧化.b= a.——青夏教育精英家教网——
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.(1)在定向爆破中.常利用氧化铁与铝反应放出的热量来切割钢筋.该反应的化学方程式为__.(2)已知:2Fe2O3=3CO2 △H=+468.2 kJ·mol
金属在日常生活中应用广泛.(1)用锌片和硫酸铜溶液的反应可呈现“铁树开花 的美景.该反应的化学方程式是 .(2)铁制品在喷漆前需放入稀盐酸中除锈.除铁锈的化学方程式是 . Zn + CuSO4 === ZnSO4 + Cu Fe2O3 + 6HCl === 2FeCl3 + 3H2O [解析] (1)锌和硫酸铜反应生成硫酸锌和铜.反应的化学方程式是Zn + 题目和参考答案——青夏教育精英家教网——
二氧化硫可作为食品防腐剂吗?
工业烟气脱硫就是除去烟气中的二氧化硫.一种采用“双碱法 脱硫的工业流程示意图如下:(1)吸收塔中用 NaOH 溶液吸收 SO2.发生反应的化学方程式是2NaOH+SO2=Na2SO3+H2O.NaOH 溶液喷成雾状能充分吸收 SO2 的原因是增大反应物之间的接触面积.使反应更快更充分.(2)完成沉淀室中反应的化学方程式:Na2SO3+Ca(OH)2=Ca 题目和参考答案——青夏教育精英家教网——
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:(1)铁元素在周期表中的位置是 .(2)写出Fe与稀硫酸反应的离子方程式 .(3)已知:Fe2O3(s)+C(s)=CO2,△H=+234.1kJ/molC(s)+O2(g)=CO2(g); △H=
16g硫跟32g氧气完全反应.生成 g二氧化硫.有16g硫在40g氧气中充分燃烧.则生成二氧化硫的质量 56g(填“> “< 或 “= ) 32 ? [解析]①根据S+O2SO2可知硫和氧气的质量比为32:32.故“16g硫跟16g氧气恰好完全反应 .生成二氧化硫的质量=参与反应的硫的质量+参与反应的氧气的质量=16g+16g=32g,②由题意可知“16g硫跟16g 题目和参考答案——青夏教育精英家教网——
(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:(1)铁元素在周期表中的位置是。(2)写出Fe与稀硫酸反应的离子方程式。(3)已知:Fe2O3(s)+C(s)=CO
(1)硝化法是一种古老的生产硫酸的方法.同时实现了氮氧化物的循环转化.主要反应为:NO2SO3 ΔH=
随便看看
- [问题]:如图1.在△ABC中.BE平分∠ABC.CE平分∠ACB.若∠A=80°.则∠BEC= ,若∠A=n°.则∠BEC= .[探究]:(1)如图2.在△ABC中.BD.BE三等分∠ABC.CD.CE三等分∠ACB.若∠A=n°.则∠BEC= ,(2)如图3.在△ABC中.BE平分∠ABC.CE平分外角∠ACM.若∠A=n°.则∠BEC= ,(3)如图4.在△ABC中.BE平分外角∠CBM. 题目和参考答案——青夏教育精英家教网——
- 太力 真空压缩袋旅行收纳袋衣物棉被抽真空整理袋立体式打包真空袋8件套 免抽气工具 *3件 104.79元(合34.93元/件)
- 星巴克=涮锅水?终于知道意大利为什么没有星巴克了
- 行李衣服打包技巧 13个改变你生活的打包技巧
- 出门旅游,有哪些整理打包行李的小技巧?

