过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题:(1)已知:H2(g)+12O2(g)=H2O(l)△H1=
3D打印技术将广泛应用于建筑、医疗等领域,定制化产品将更加丰富。 #生活知识# #生活感悟# #科技生活变迁# #未来生活方式预测#
 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+O2(g)=H2O(l)△H1=-286kJ•mol-1
H2(g)+O2(g)=H2O2(l)△H2=-188kJ•mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=
-196
-196
kJ•mol-1。
不同温度下过氧化氢分解反应的平衡常数K(313K)
小于
小于
K(298K) (填>、<或=)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是
Cr3+
Cr3+
。
贮运过氧化氢时,可选用的容器材质为
B
B
(填标号)。
A.不锈钢B.纯铝C.黄铜D.铸铁
(3)过氧化氢的Ka1=2.24×10-12,H2O2的酸性
>
>
H2O (填>、<或=)。
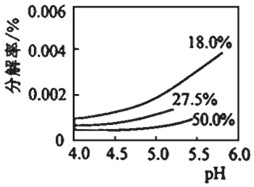
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是
pH升高,c(HO2-)增大,分解速率加快
pH升高,c(HO2-)增大,分解速率加快
:相同pH下,过氧化氢浓度越大分解率越低的原因是
H2O2浓度越大,其电离度越小,分解率越小
H2O2浓度越大,其电离度越小,分解率越小
。
【思考】(1)根据盖斯定律计算所求反应的焓变,根据过氧化氢分解反应的焓变分析温度对化学平衡常数的影响;
(2)根据表中数据分析,Cr3+加入量最少,H2O2的分解率最大,Al3+对H2O2分解的影响最小,贮运过氧化氢时,要求容器材质不能促进H2O2的分解;
(3)根据过氧化氢的Ka1和Kw比较,根据图象,pH增大,H2O2分解率增大,考虑到pH增大,溶液中c(HO2-)增大,促进H2O2的分解,相同pH下,过氧化氢浓度越大分解率越低,考虑H2O2浓度越大,电离度越小。
【解答】解:(1)已知:①H2(g)+O2(g)=H2O(l)△H1=-286kJ/mol,
②H2(g)+O2(g)=H2O2(l)△H2=-188kJ/mol,
所求反应为:2H2O2(l)=2H2O(l)+O2(g),反应可由①×2-2×②得到,根据盖斯定律,该反应的焓变为△H=2△H1-2△H2=-196kJ/mol,
过氧化氢分解反应为放热反应,温度升高不利于反应正向进行,所以化学平衡常数降低,所以不同温度下过氧化氢分解反应的平衡常数K(313K)小于K(298K),
故答案为:-196;小于;
(2)根据表中数据分析,Cr3+加入量最少,H2O2的分解率最大,所以能使过氧化氢分解反应活化能降低最多的离子是Cr3+,
Al3+对H2O2分解的影响最小,贮运过氧化氢时,要求容器材质不能促进H2O2的分解,所以应选纯铝,
故答案为:Cr3+;B;
(3)根据过氧化氢的Ka1和Kw比较,过氧化氢的Ka1=2.24×10-12>Kw,所以H2O2的酸性>H2O,
根据图象,pH增大,H2O2分解率增大,考虑到pH增大,溶液中c(HO2-)增大,促进H2O2的分解,
过氧化氢浓度越大分解率越低,考虑H2O2浓度越大,电离度越小,
故答案为:>;pH升高,c(HO2-)增大,分解速率加快;H2O2浓度越大,其电离度越小,分解率越小。
【解读】本题考查过氧化氢的有关知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意外界因素对化学反应速率的影响,(4)③计算是该题的难点,题目难度中等。
网址:过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题:(1)已知:H2(g)+12O2(g)=H2O(l)△H1= https://www.yuejiaxmz.com/news/view/790268
相关内容
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=氨和肼(N2H4)是氮的两种常见化合物.在科学技术和生产中有广泛应用.回答下列问题:(l)已知:N2(g)+3H2(g)?2NH3(g)△H=
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol
甲烷作为一种新能源在化学领域应用广泛.请回答下列问题:(1)甲烷
碳及其含碳化合物在人们的生产生活中应用广泛。(1)天然气是人们日常生活中的清洁能源。已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ·mol-1②2CO(g)+O2(g)=2CO2(g);△H2=
CO和H2作为燃料和化工原料.有着十分广泛的应用.+O2(g)═CO2(g)△H1=
丙烯是重要的有机化工原料,丁烯催化裂解法是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:I主反应,3C4H8(g)=4C3H6(g)△H1
17.氢气(H2)一氧化碳(CO).辛烷(C8H15).甲烷(CH4)的热化学方程式分别为: H2(g)+O2(g)====H2O(1); △H=
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.请回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g)K1△H1=a
环氧乙烷是高效消毒剂,可用于口罩等医用品消毒,工业常用乙烯氧化法生产。主反应:2CH2=CH2(g)+O2(g)ΔH1=−209.8kJ∙mol−1,副反应:C

