Ⅰ.醋酸(已知:25℃,Ka(CH3COOH)=1.69×10-5)是日常生活中最常见的调味剂和重要的化工原料。下列实验方案能说明醋酸是弱酸的是
糖醋排骨的糖醋比例一般是1:1:醋的酸味能中和糖的甜,口感酸甜适中。 #生活常识# #烹饪秘籍#
题型:解答题-实验探究题 难度:0.65 引用次数:205 题号:6555091
Ⅰ.醋酸(已知:25℃,Ka(CH3COOH)=1.69×10-5)是日常生活中最常见的调味剂和重要的化工原料。下列实验方案能说明醋酸是弱酸的是
________________________a配制0.10mol / L的醋酸溶液,向其中滴入几滴甲基橙试液,然后再加入少量醋酸钠晶体,振荡。
b配制0.10mol / L的醋酸钠溶液,加入几滴酚酞试液。
c 取一定量的无水醋酸配制0.1mol/L的醋酸溶液,测溶液的pH值。
Ⅱ.某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL), 实验步骤:
⑴取10.00mL市售白醋样品,稀释配成100mL的食醋溶液。
⑵用酸式滴定管取稀释后食醋溶液20.00mL于锥形瓶中。
⑶用
盛装0.1000mol/L NaOH标准溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
⑷滴定,并记录NaOH的终读数。重复滴定2-3次。
实验记录及数据处理
实验数据1234V(样品)/mL20.0020.0020.0020.00V(NaOH)/mL(初读数)0.000.2000.100.00V(NaOH)/mL(终读数)14.9815.2015.1215.95V(NaOH)/mL(消耗)14.9815.0015.0215.95
回答如下的问题:
①步骤⑶中使用到的某仪器名称是
②常温下,醋酸和氢氧化钠溶液恰好反应时,溶液pH
________7(填“>”、“=”或“<”)。
③下列指示剂中,最适合于本实验的是
A. 0.1%甲基橙溶液 B. 0.1%酚酞溶液 C. 0.1%石蕊溶液
滴定终点的判断依据是
④根据实验数据,样品总酸量=
_______ g / 100mL。(醋酸的相对分子质量为60)
⑤若滴定时,读取NaOH溶液的初读数时仰视读数,滴定结束时俯视读数,则求得的醋酸溶液的物质的量浓度
A.偏低 B.偏高 C.偏低或偏高或不能确定 D.不受影响
更新时间:2018/06/22 16:31:19 |
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐【推荐1】某同学用的标准溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
A.移取待测盐酸注入洁净的锥形瓶中,并加入2~3滴酚酞溶液;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液;
D.取标准溶液注入碱式滴定管到“0”刻度以上;
E.调节液面至“0”或“0”刻度以下,记下读数;
F.把锥形瓶放在滴定管的下方,用标准溶液滴定到终点,并记下滴定管液面的读数。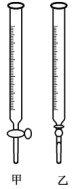
(1)上图中属于碱式滴定管的是
(填“甲”或“乙”)。
(2)正确的操作顺序是
(用字母表示)。
(3)上述B步操作的目的是
。
(4)判断到达滴定终点的实验现象是
。
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填“偏大”“偏小”或“无影响”)。
(6)若平行实验三次,记录的数据如下表:
则待测盐酸的物质的量浓度为
___________。
【推荐2】某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要
。
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上。
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”刻度线以下,并记录读数。
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液。
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号)
.该错误操作会导致测定结果
_______(填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应
;
③判断滴定终点的现象是
。
④若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果
(填“偏大”、“偏小”或“无影响”)。
【推荐3】为验证铁元素的氧化还原能力,利用如图所示电池装置进行实验。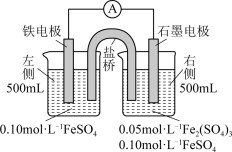
(1)电子由铁电极流向石墨电极,盐桥中的阳离子向
移动(填“左侧”或“右侧”)。
(2)电池反应一段时间后,石墨电极上未见Fe析出且无气体逸出。测得左侧烧杯溶液c(Fe2+)增加了0.02 mol·L-1,右侧烧杯溶液中c(Fe2+)=
。
(3)以上实验结果得知石墨电极的电极反应式是
。验证了Fe2+氧化性弱于
___________。
(4)为进一步了解Fe2+在氧化还原反应中得失电子的情况,可用标准物质的量浓度的酸性KMnO4溶液对Fe2+进行滴定,滴定时酸性KMnO4溶液应装在
滴定管中,判断滴定终点的现象是
___________。若滴定前平视读数滴定后仰视读数则所测溶液中c(Fe2+)浓度
___________(填“偏大”“偏小”或“不变”)
网址:Ⅰ.醋酸(已知:25℃,Ka(CH3COOH)=1.69×10-5)是日常生活中最常见的调味剂和重要的化工原料。下列实验方案能说明醋酸是弱酸的是 https://www.yuejiaxmz.com/news/view/351950
相关内容
Ⅰ.醋酸(已知:25℃,Ka(CH3COOH)=1.69×10-5)是日常生活中最常见的调味剂和重要的化工原料。下列实验方案能说明醋酸是弱酸的是(1)已知25℃时有关弱酸的电离平衡常数:弱酸化学式HSCNCH3COOHHCNH2CO3电离平衡常数1.3×10
醋酸钠的用途是什么?
醋酸面料怎么洗和保养
小军同学在学完“酸的化学性质 后.邀请你与他讨论“食醋在厨房中的妙用 :(1)复习酸的化学性质①酸与指示剂作用酸溶液能使紫色石蕊溶液变红色酸溶液不能使无色酚酞溶液变色②酸与活泼金属作用Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑③酸与某些金属氧化物作用Fe2O3+HCl=FeCl3+H2O
酸甜味的家常菜有哪些 10款酸酸甜甜的家常菜 味美超下饭
十大酸味家常菜 口味偏酸的家常菜 带酸味的家常菜做法推荐
甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:COCH3OH(g).已知①常压下反应的能量变化如图所示.②③CO ΔH=
课题2 酸和碱的中和反应说课稿【一等奖】
等浓度NaOH滴定一元弱酸时,当中和一半酸时,pH = 5.5,弱碱的Ka为()

