人类葡萄糖、脂质和能量代谢的昼夜节律调节
白天多晒太阳,帮助调节昼夜节律 #生活知识# #科技生活# #健康生活技巧# #睡眠卫生#
昼夜节律系统以每天 24 小时为周期协调新陈代谢。这种节律通过暂时分离相反的代谢过程和预测重复的进食禁食周期来提高代谢效率来组织新陈代谢。尽管动物研究表明昼夜节律系统在调节新陈代谢方面起着普遍的作用,但尚不清楚啮齿动物的昼夜节律研究如何以及在多大程度上转化为人类。在这里,我们回顾了昼夜节律系统调节人类葡萄糖、脂质和能量代谢的证据。使用一系列实验方案,人类研究报告了葡萄糖、胰岛素、葡萄糖耐量、脂质水平、能量消耗和食欲的昼夜节律。其中一些节律在生物早晨或中午左右达到顶峰,暗示白天早些时候是食物摄入的最佳选择。重要的是,这些节律的破坏会损害新陈代谢并影响代谢性疾病的发病机制。因此,我们还评价了由不合时宜的光照、睡眠或食物摄入引起的昼夜节律失调对人类代谢健康产生不利影响的证据。昼夜节律系统、新陈代谢和行为之间的这些相互联系强调了时间生物学对预防和治疗 2 型糖尿病、肥胖症和高脂血症的重要性。
昼夜节律系统在昼夜节律的日常周期中组织新陈代谢、生理和行为。昼夜节律源自拉丁词根 circa- 意思是周围和 diēm 意思是白天,与所有日常或昼夜节律一样,昼夜节律是大约每 24 小时重复一次的周期性模式。然而,与昼夜节律不同,昼夜节律是在生物体内内源性产生的,即使在没有外部时间线索的情况下也会持续存在(图1).这种昼夜节律已经进化了数亿年,通过暂时分离相反的代谢过程(如合成代谢和分解代谢)和预测反复进食-禁食周期来优化代谢效率来协调代谢[1-3]。

图1昼夜节律词汇表。
昼夜节律系统包括大脑中的中央起搏器和全身外周组织中的一系列时钟,包括肝脏、肌肉和脂肪组织。这种时钟系统共同调节多种代谢靶标,例如糖皮质激素[4],主能量传感器AMPK [5],脂肪酸和胆固醇合成中的限速步骤[6,7],以及用于调节糖异生的肝脏CREB[8]。总体效应是一系列代谢过程 - 包括胰岛素敏感性,胰岛素分泌,胆固醇合成,脂肪氧化和能量消耗 - 都在一天24小时内遵循节奏[2,3,9]。
除了代谢中昼夜节律的证据外,越来越多的数据表明,昼夜节律系统的破坏会增加代谢性疾病的风险[9-12]。在啮齿动物研究中,时钟基因突变体通常表现出肥胖或糖尿病表型,并且在胰岛素分泌和糖异生等核心代谢途径中存在缺陷[3,13-17]。此外,啮齿动物昼夜节律失调常导致食欲亢进、胰岛素抵抗和高血脂血症[9-12]。在人体试验中,昼夜节律失调同样会升高葡萄糖、胰岛素和甘油三酯水平[18-20]并降低能量消耗[21]。因此,了解这些节律对于何时进食、睡觉、暴露在强光下、进行体力活动,甚至何时服用药物以降低代谢性疾病风险非常重要[22-24]。
虽然在动物模型中有大量的机制数据证明昼夜节律系统在新陈代谢中的广泛作用,但对人类的试验相对较少。鉴于啮齿动物在几个关键方面与人类不同 - 例如夜间活动,多相(每天睡眠超过一次)以及单位体重的高代谢率 - 目前尚不清楚啮齿动物的昼夜节律和昼夜研究如何以及在多大程度上转化为人类。在本综述中,我们综合了人类代谢昼夜节律调节的证据。在第1节中,我们概述了昼夜节律系统的结构和测量人类昼夜节律的协议。在第2节中,我们总结了人类葡萄糖,脂质和能量代谢中昼夜节律和昼夜节律的证据。在第3节中,我们最后讨论了昼夜节律对齐或与三个外部因素(光,睡眠和食物摄入)的错位如何影响新陈代谢和代谢疾病的风险。
1. 昼夜节律生物学
1.1. 昼夜节律系统的架构
昼夜节律系统由两部分组成:(1) 位于下丘脑视交叉上核 (SCN) 的中央时钟和 (2) 位于身体几乎所有其他组织中的一系列外周时钟,包括肝脏、胰腺、胃肠道、骨骼肌和脂肪组织(图2).中央时钟被认为通过弥散因子(主要是皮质醇和褪黑激素)和突触投射(包括通过自主神经系统)来调节代谢[25,26]。外周组织将这些来自时钟的信号与环境和行为因素(包括光照、睡眠、体力活动和进食)以及自身的自主节律相结合,以有节奏的方式调节代谢[27]。自主的细胞内节律在分子水平上由形成转录-翻译反馈环(TTFL)的时钟基因和蛋白质维持。TTFL以~24小时为周期运行,激活涉及数千个靶基因的转录和转录后事件的节律级联[28]。总的来说,约10%的遗传转录本表现出昼夜节律周期性,此外,更多的蛋白质在转录后和翻译后水平上经历昼夜节律引起的振荡[28]。
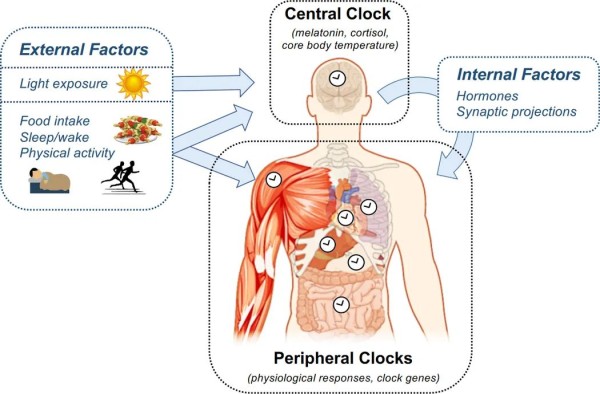
图2昼夜节律系统的架构
昼夜节律系统包括位于下丘脑SCN的中央时钟和位于全身组织中的一系列外周时钟。中央时钟主要由光夹带,其节律通过频繁采样褪黑激素、皮质醇或核心体温来测量。中央时钟通过激素和突触投射影响外周时钟的相位和振幅。外围时钟由来自中央时钟的这些信号和外部因素的组合所夹带,最明显的是食物摄入的时间。通过直接测量生理变量中的节律或通过测量时钟基因的表达来测量人类的外周时钟节律。总体而言,新陈代谢的日常节律是由中央和外围时钟协同工作产生的。
每个昼夜节律的时间(阶段)由称为夹带过程中的外部和内部因素决定。中央时钟的节律主要由强光夹带,而外周组织中的节律则来自中央时钟的输入、外部因素(包括光、体力活动、进食和睡眠)和代谢物的整合[25,27]。最近,食物摄入的时间已成为决定外周时钟相位的关键时代精神或外部因素之一[29,30]。由于不同的刺激设置了中央和外围时钟的相位,因此每当它们各自的时代精神不同步时,两个时钟系统就会错位。这种错位会破坏新陈代谢,因为两个时钟系统共同协调相互依赖的代谢途径。正如我们将在第3节中讨论的那样,现在几项对照试验表明,昼夜节律失调会增加患代谢疾病的风险。
1.2. 测量昼夜节律
测量节律的昼夜节律成分具有挑战性,需要匹配或消除所有随时间变化的外部因素,以隔离昼夜节律(内源性)节律[31]。迄今为止,已经开发了四种用于测量人类昼夜节律的方案(图3详细说明)[31,32]。这些协议中的每一个都有独特的优点和缺点。恒定例行 (CR) 协议涉及超过 24 小时的长时间清醒(不睡眠),在此期间所有外部因素(包括光、温度和喂养)都保持恒定。由于所有外部因素都保持不变,因此在CR协议期间观察到的任何节律都被认为是纯昼夜节律,仅由内源性昼夜节律系统产生。其他三种方案允许外部因素存在并允许参与者入睡,但涉及改变睡眠时间以在一天24小时的不同部分循环。然后使用数学技术来提取节律的昼夜节律成分。因此,这些协议的优势在于提供有关节律的昼夜节律和外部(行为)成分的信息,以及昼夜节律失调的影响。强制不同步 (FD) 协议要求参与者通常每天生活 20 或 28 小时,持续 1-2 周,并允许重建完整的昼夜节律和行为节律。相比之下,昼夜节律对齐/错位 (CA/M) 协议和倒置睡眠-觉醒周期协议涉及白天和夜间睡眠,因此能够估计昼夜节律系统相对于外部因素的相对贡献。在第2节中,我们重点介绍使用这些协议的试验。鉴于此类试验的稀缺性,我们还利用测量昼夜节律的研究来提供历史背景并指出未来调查的领域。
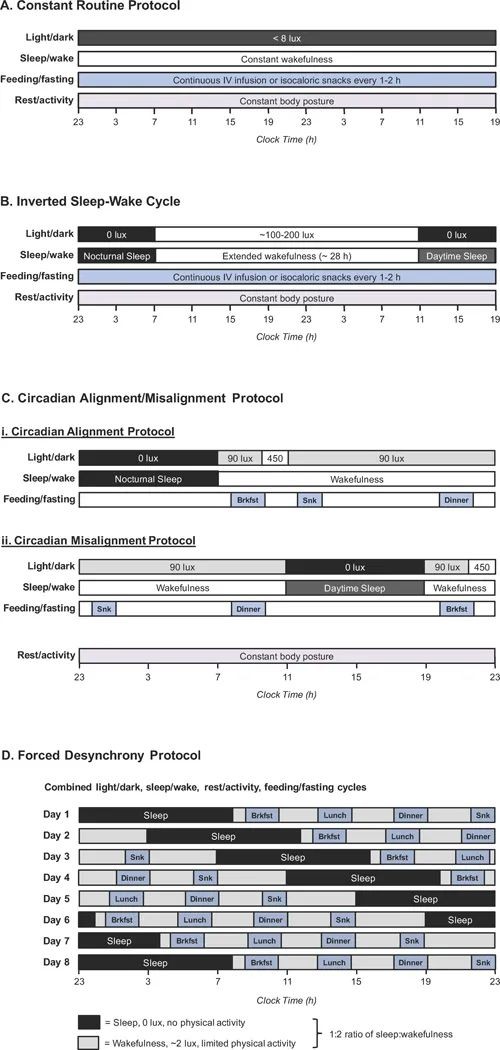
图3研究人类昼夜节律的四种方案
(A)恒定常规协议涉及超过24小时的持续清醒期,其中所有外部因素(包括光线,姿势,喂养和温度)保持恒定。该协议允许重建整个昼夜节律,但不能调查昼夜节律错位。(B)倒置睡眠-觉醒周期包括夜间和白天睡眠的时期,由长时间的觉醒分开。在整个方案中,喂养和姿势通常保持不变,但光照水平设置为与睡眠/觉醒的变化相匹配。该协议提供了对昼夜节律和行为周期的洞察。(C)昼夜节律对齐/错位协议包括两个子协议:白天行为周期正常发生的对齐协议,以及未对齐的协议,这些相同的行为周期发生在生物夜间。光照水平各不相同,参与者吃正常的膳食和零食。虽然该协议不允许重建潜在的昼夜节律,但它确实揭示了昼夜节律受昼夜节律阶段(即一天中的时间)、昼夜节律失调和行为因素的影响程度。(D)强制不同步协议涉及每天遵循20或28天小时,通常为1-2周,以循环通过昼夜节律和行为节律之间的不同对齐。清醒期间的光照水平保持在非常低的水平,参与者食用正常的膳食和零食。然后使用数学程序提取昼夜节律的潜在昼夜节律与行为成分。该协议还揭示了昼夜节律错位对生物终点的影响。
2. 代谢中的昼夜节律和昼夜节律
2.1. 葡萄糖代谢
2.1.1 昼夜研究
昼夜节律调节葡萄糖代谢的第一个证据出现在1960年代末和1970年代,当时有几项研究报告了葡萄糖耐量的昼夜变化[33-47]。此后,已有十多项人体研究报道,口服葡萄糖耐量存在昼夜节律,通常在早晨达到峰值,下午和晚上糖耐量受损[33-49]。重要的是,这些时间效应与禁食持续时间无关[40,48]。使用静脉注射葡萄糖或胰岛素耐量试验[46,50-54]和混合膳食[55-62]的研究也报告了类似的发现。(然而,下午和晚上的空腹血糖通常低于早上[51,63]。葡萄糖耐量昼夜变化的大小非常大:早晨葡萄糖耐量正常的成年人在代谢上相当于晚上的糖尿病前期[33,36,46]。最近,我们报道了糖尿病前期成人在40:19h时的口服葡萄糖耐量比00:7时高00mg/dl,这使得糖尿病前期成人在晚餐时间的代谢与早期糖尿病患者相当[63]。
葡萄糖耐量的这些昼夜变化可以部分追溯到β细胞反应性、胰岛素分泌和胰岛素清除的昼夜节律。尽管空腹胰岛素中存在昼夜节律的数据是混合的[51,64,65],但胰岛素分泌反应在一天中有所不同。β细胞反应性(通过葡萄糖耐量、混合餐或静脉注射甲苯磺丁脲检测来衡量)在早晨高于一天中的其他时间[37, 46, 50, 52, 55, 57, 64, 66]。 然而,胰岛素分泌率和对餐后分泌的总胰岛素似乎在当天晚些时候达到峰值[55-57,62,67]。 一项使用68小时正常血糖和高血糖钳夹的试验发现,胰岛素分泌率在下午中午(12:00-18:00)达到峰值,在夜间受试者睡觉时最低[67]。同样,采用静脉葡萄糖耐量试验和使用C肽反卷积分析的混合膳食试验的试验报告说,由于分泌期延长,下午或傍晚的总胰岛素分泌(胰岛素分泌率的AUC)比早上高16-51%,即使分泌速率峰值没有明显的昼夜节律[55-57, 62]胰岛素清除率也表现出昼夜变化:早晨肝胰岛素提取率低于傍晚[55]。
外周胰岛素敏感性的节律似乎也有助于血糖控制的昼夜变化。一项试验对正常体重受试者进行了频繁采样的静脉葡萄糖耐量试验,发现与早晨相比,晚上的胰岛素敏感性受损了34%[50]。使用胰岛素耐量试验[46,68,69],使用三重示踪剂技术的混合餐耐受性试验[55],使用同位素示踪剂的恒定葡萄糖输注程序[70]以及24小时葡萄糖控制胰岛素输注程序[71].外周胰岛素敏感性的昼夜节律可能是由于介导葡萄糖摄取的核心细胞内途径和循环因子。骨骼肌中约15%的转录本表现出节律模式[72],包括参与葡萄糖和脂质代谢的基因[61,72,73]。 肌肉和肝脏糖原含量呈~17%峰谷变化,在晚上达到峰值[74]。皮下脂肪组织(而非内脏脂肪组织)在胰岛素敏感性方面也表现出大振幅的昼夜节律:脂肪组织中午的胰岛素敏感性比午夜高54%[75]。循环因素也可能有所贡献。游离脂肪酸(FFAs)表现出昼夜节律,反映了葡萄糖稳态的昼夜周期性[39,46,59,61,68]。在以恒定速率输注葡萄糖的研究中,诱导胰岛素抵抗的生长激素[76]与夜间睡眠期间(22:00-2:00)的葡萄糖水平密切相关[77]。由中央时钟调节的皮质醇也可能是血浆葡萄糖和胰岛素昼夜节律变化的原因。输注氢化可的松以提高皮质醇水平可急性抑制胰岛素分泌,并在约4-6小时后诱导外周胰岛素抵抗,持续长达12-16小时[78,79]。
参与介导葡萄糖摄取的其他途径也可能在昼夜节律控制之下。早晨的葡萄糖有效性(胰岛素非依赖性葡萄糖的指标)摄取量高于晚上[50]。然而,关于肝胰岛素敏感性的数据相互矛盾:一项使用钳夹操作的试验未发现节律[70],而另一项使用三重示踪混合餐方法的试验表明,早晨内源性葡萄糖产生和肝胰岛素敏感性均较低[55]。由于摄入混合餐后葡萄糖吸收率没有昼夜节律[55],两项研究之间的这种差异可以用肠促胰岛素分泌的昼夜节律来解释,这在膳食耐量试验中很明显,但在钳夹手术中则不明显。
有趣的是,肥胖个体的糖耐量、胰岛素水平和外周胰岛素敏感性的昼夜节律减弱、相位延迟或缺失[35,39,49,50],老年人可能会改变[39,54]。 此外,在成人2型糖尿病患者中,它们不存在或倒置(相位延迟数小时)[34,35,47,62,80]。一项使用钳夹手术的试验报道,成人2型糖尿病患者缺乏外周胰岛素敏感性的昼夜节律[80];它们在肌肉糖原贮藏方面也缺乏昼夜节律[74]。然而,糖尿病成人在肝糖原贮积[74]和肝胰岛素敏感性方面表现出清晰的节律,这是通过钳夹手术结合示踪剂测量的[80,81]。最终结果是糖尿病成人的全身胰岛素敏感性在~07:00小时最高,在早晨最低。这种肝胰岛素敏感性的节律可以解释糖尿病成人早晨空腹高血糖的“黎明现象”。为什么以及如何改变这些昼夜节律在肥胖和糖尿病患者中是进一步研究的重要领域。
2.1.2 昼夜节律研究 在过去的
几十年里,重要的努力阐明了昼夜节律系统对葡萄糖代谢的影响,无论有没有睡眠的影响——睡眠是已知影响葡萄糖稳态的因素。
Shapiro等人对24例健康成人进行了8小时持续葡萄糖输注,报告血糖峰值水平出现在清晨(平均:2:28小时;范围:0:45-3:50),比白天最低点高出32%[82]。虽然在所有参与者中平均胰岛素分泌率似乎没有节律,但在一半的成年人中,胰岛素分泌率与葡萄糖节律同时达到峰值。(相比之下,其余大多数参与者没有胰岛素分泌节律。然而,最近一项试验在2例健康男性中每6小时使用CR方案,每10小时吃一次等热量零食,结果显示葡萄糖和胰岛素存在内源性昼夜节律,峰谷振幅分别为22%和83%,峰值水平大约出现在习惯性觉醒时或之后不久[23]。在健康成人中,00:7-00:3睡眠不会显著改变葡萄糖节律的平均相位(39:0h),但可能会将相位范围扩大至15:5-45:28,并将峰谷变化增加至~84%[03]。然而,在包括睡眠的同一试验中,胰岛素水平的肢端分布在很宽的时间范围内(00:17-15:21小时),导致没有显着的组水平峰值。00名受试者中有01名的胰岛素水平最低点发生在00:6-9:17之间,胰岛素值比24小时平均值低24%。另一项试验对糖尿病成人和(肥胖)BMI匹配对照受试者进行了19小时葡萄糖输注,发现健康肥胖和糖尿病成人的早晨血糖水平最高,~00:20和~30:85时最低[24]。相对于BMI匹配的对照受试者,糖尿病成人的葡萄糖振幅大约是其两倍(高于最低点13%对<>%)。虽然夜间葡萄糖水平的升高在数量和时间上与皮质醇水平的升高相关,但胰岛素分泌率的夜间升高仅在健康受试者中与葡萄糖平行,而不是糖尿病成年人;事实上,在糖尿病成人中,胰岛素分泌率的时间节律并不明显。葡萄糖和胰岛素节律的这些差异可能部分是由于糖尿病患者与健康成人皮质醇节律的时间和幅度不同。
试验也使用FD,CA/M和倒置睡眠-觉醒周期方案进行。Owens等人在9名健康年轻女性中使用FD方案,发现3小时葡萄糖增量AUC在08:00时最低,在58:66和14:00时高出02-00%,在99:20时最高(高出00%);相比之下,空腹血糖的节律相反,最低为20:00小时[86]。Scheer等人还在10例健康成人中使用了FD方案,发现葡萄糖表现出昼夜节律,峰谷幅度小,为4%,肢端在~22:30-06:30之间,而胰岛素缺乏昼夜节律[18]。最近,Morris等人在14例健康、非肥胖成人中使用CA/M方案,发现虽然空腹血糖水平不受昼夜节律期的影响,但与早晨相比,生理晚的葡萄糖耐量降低了17%,2小时葡萄糖AUC高出12%[64]。此外,早期胰岛素AUC比早上高27%,晚上空腹胰岛素水平较低。最后,Van Cauter等人将倒置睡眠/觉醒周期方案与8例健康男性的恒定葡萄糖输注相结合,发现葡萄糖的肢端期发生在02:35±0:33h,夜间睡眠与夜间觉醒的峰值水平分别比下午水平高出31%和17%[77]。白天睡眠时的葡萄糖水平也比清醒时高16%,这表明睡眠确实会影响葡萄糖的昼夜节律。在同一项试验中,胰岛素分泌速率的肢端相与葡萄糖相似,但偏移幅度更大,为49-60%。胰岛素水平在很大程度上反映了胰岛素分泌率,在夜间睡眠期间增加了41%,在白天睡眠中增加了39%,但在夜间觉醒期间没有。相应。睡眠期间和夜间胰岛素清除率较高;特别是,夜间睡眠(30:40 – 23:00 h)的胰岛素清除率比早晨清醒(3:00 – 8:00)高11-00%。同一位作者使用类似的方案比较了9例肥胖男性和9例瘦男性,发现肥胖受试者的糖耐量节律逆转,表明葡萄糖耐量随着一天的进展而改善[87]。此外,肥胖受试者的葡萄糖和胰岛素节律变钝,相位提前~1.5-2小时,醒来后早晨葡萄糖水平仍然升高。
综上所述,这些发现表明葡萄糖耐量表现出昼夜节律变化,健康成年人晚上和晚上的血糖控制较差。β细胞反应性的昼夜节律、外周胰岛素敏感性(受内部和循环因素的影响)、胰岛素清除率和葡萄糖有效性驱动这些昼夜节律在葡萄糖代谢中,而肝胰岛素敏感性可能起的作用较小。然而,这些节律在肥胖和糖尿病成人中减弱或相位延迟,这表明昼夜节律改变可能是许多代谢疾病的原因或结果。
2.2. 脂质代谢
尽管众所周知,昼夜节律系统在啮齿动物的基因和蛋白质水平上调节脂质代谢途径中的几个限速步骤[88,89],但在人类中知之甚少。
2.2.1 昼夜研究
一些研究检查了人类胆固醇及其亚成分的昼夜节律,结果相互矛盾(例如[59,90-98])。一项试验报道,与白天(01:00小时)相比,夜间(13:00小时)单餐餐的餐后甘油三酯水平较高,而总胆固醇、LDL-C、HDL-C和载脂蛋白水平较低[90]。在检查24小时节律时,两项针对欧洲高加索成人的研究报告了总胆固醇和低密度脂蛋白胆固醇节律,振幅适中,分别为~6-7mg/dl和~10%[91,92],而针对西班牙和印度成人的试验报告了总胆固醇和LDL胆固醇的幅度更大,为~20-30%[93,94]。 试验在肢端阶段不一致,报告的阶段范围从清晨(~8:00-9:00)[92]到傍晚(14:45-18:36)[93,94]。对于HDL-C,昼夜节律的证据好坏参半:在印度和西班牙成人中进行的试验发现HDL-C的振幅节律非常小(2-4%)[93,94],而两项针对高加索人的试验报告不存在节律[91,92]。其他研究调查健康男性和女性的数据显示,总胆固醇或HDL-C水平没有显著的昼夜变化[95-97]。
虽然大多数研究都认为甘油三酯表现出昼夜节律[91-93](有一个例外[59]),一天内变化高达33-63%,但他们在阶段上并不一致。例如,15项试验报告了男性在下午(~00:17小时)或晚上(~45:20-00:72)出现肢端期[91,92],而另一项试验报告了男性在中午至傍晚之间的峰值,但女性没有[98]。一项基于毛细血管测量健康男性甘油三酯的研究发现了类似的发现,显示晚餐后甘油三酯的上升幅度最大[36]。生理性别可以解释甘油三酯节律的一些差异。一项研究显示,男性餐后血清甘油三酯水平的最大增幅明显比女性高24倍,且昼夜变化更大(男性为95% vs 女性为99%)[100]。这些性别相关差异可能是由于雌激素对脂质代谢的影响[101]。此外,年龄、代谢表型和方法学差异(例如测定血清与毛细血管甘油三酯[<>,<>])可能是造成一些差异的原因。
与血浆胆固醇水平的数据类似,胆固醇合成的数据缺乏共识。除了胆固醇前体节律的间接证据[102]外,一项使用模拟时差方案的研究发现,胆固醇合成速率在~22:00h达到峰值,振幅为~109%[103]。然而,一项针对男性的小型研究报道,游离胆固醇和胆固醇酯分数合成速率在~06:00h达到峰值[104]。试验之间的差异可能既源于膳食成分的差异,也源于食物摄入的时间,而不是昼夜节律系统,是胆固醇合成昼夜模式的主要决定因素[103,105]。 这表明行为和其他外部因素主要决定了胆固醇合成的节律。
研究还调查了其他脂质物种的昼夜节律。一些试验报告了FFA的昼夜变化很大,包括餐后值,大多数研究(但不是全部[64])报告下午和晚上的AUC值更高[39,46,51,54,59,61,68,72,92]。载脂蛋白A-1和B分别表现出24小时和12小时节律,但其峰谷节律的振幅很小(~5-6%)[93]。许多其他脂质物种表现出昼夜节律。一项昼夜代谢组学研究报道,磷脂、溶血磷脂酰胆碱和溶血磷脂酰乙醇胺往往在傍晚和傍晚达到高峰[106]。
这些脂质节律可能由脂质吸收、转运和分配中的昼夜节律振荡驱动。来自动物研究的新数据表明,昼夜节律系统调节肠道脂质吸收[107,108],但仍然缺乏人类证据。然而,有证据表明脂质转运和分配存在昼夜变化。在酰基肉碱中观察到昼夜节律,酰基肉碱通过将脂肪酸从细胞质转运到线粒体中来参与脂肪酸氧化:长链不饱和酰基肉碱的肢端期比长链饱和肉碱在早晨更早发生,而短链酰基肉碱在一天中没有表现出均匀的模式[106].这些数据表明,线粒体脂肪酸转运可能存在昼夜节律。经证实,线粒体氧化能力也表现出昼夜节律:健康、体重正常的年轻男性在24小时内接受了23次骨骼肌活检,骨骼肌线粒体脂质代谢呈昼夜变化,在~00:72h达到峰值[13]。另一项试验对38例超重健康女性进行了肌肉活检,发现调节脂肪酸氧化的基因在晚上相对于早晨下调了82%-51%,而参与新生脂肪生成的基因上调了87%-61%[<>]。基因表达的这种变化,没有脂肪组织脂肪分解的相应变化,有利于骨骼肌脂肪酸分配从早上的氧化转变为晚上的脂肪生成。
2.2.2 昼夜节律研究 昼夜
节律研究表明,比任何其他类别的血浆代谢物经历昼夜节律调节的脂质比例更高。Dallmann等人的一项针对10例使用CR方案的男性的显著代谢组学研究表明,15%的血浆代谢物表现出昼夜节律,而这些节律化合物中有80%是脂质代谢物[109]。大多数脂质物种在上午中午至中午之间达到峰值水平。另一项CR研究采用基于脂质组学的方法,检查了263例健康年轻男性血浆中的20种脂质(甘油脂、甘油磷脂、鞘脂、游离胆固醇、胆固醇酯和LDL胆固醇)[110]。除了节律的时间和幅度存在明显的个体间差异外,组级分析还显示13%的脂质物种存在昼夜节律振荡,跨越参与能量储存,运输和信号传导的脂质。大多数表现出昼夜节律变化的脂质是甘油三酯和甘油二酯,并且多个肢端相在早晨。相比之下,磷脂酰胆碱在晚上达到峰值,而低密度脂蛋白胆固醇没有表现出昼夜节律(尽管白天的值往往更高)。然而,血脂节律的阶段在个体之间变化长达12小时,受试者间关于脂质节律的一致性仅为18%。此外,根据甘油三酯和磷脂酰胆碱亚群的节律强度对个体进行聚类,这表明可能存在不同的昼夜节律表型。仅6例纳入111例年轻男性的CR研究支持了如此广泛的变异性,该研究发现甘油磷脂和鞘脂节律的时间存在高度变异[14]。最后,一项研究使用CA/M方案测量了64例健康成人脂质节律的昼夜节律成分,发现空腹和餐后FFA水平不受昼夜节律期的影响[<>]。
总之,脂质比任何其他血浆代谢物受到昼夜节律系统的更广泛调节[109],多个肢端在早晨或中午左右达到峰值。这些节律至少部分是由脂质合成、转运和分配的差异驱动的。然而,脂质节律以及节律的时间和强度存在广泛的个体间变异性,这表明可能存在不同的昼夜节律代谢表型。需要更多的对照试验来确定脂质节律个体间变异的性质和程度。
2.3. 能量代谢
动物研究表明,在分子和全身水平上能量代谢的昼夜节律[1,89,112]。在人类中,到目前为止,大多数证据都是在全身水平上。两项试验使用CR方案来测量能量消耗和底物氧化中的昼夜节律。一项试验对7例健康年轻男性使用了间接量热法,报告能量消耗的峰谷幅度为17%,峰值出现在9:00-12:00h之间,谷值出现在24:00-06:00之间[113]。第二项试验纳入了10例健康年轻男性,测量了耗氧量和二氧化碳产生,发现两个变量的峰谷幅度均较小,为6%[114]。两项试验均报告呼吸道商数(RQ)无显著昼夜节律变化,表明相对底物氧化速率[113,114]。 另一项纳入15例肥胖成人的试验纳入了在整个24小时周期内禁食的受试者,同样报道了能量消耗的昼夜节律,肢端发生在下午(13:15-17:23)[115]。同一作者的研究,但不是在CR或空腹条件下,也报告了底物氧化中的昼夜节律[116,117]。 有一些机制证据支持能量代谢的昼夜节律:一项采用模拟典型日常生活的方案的非对照研究报道,骨骼肌氧化能力的昼夜变化为20%,状态3线粒体呼吸(即ADP刺激呼吸)在23:00时最高[72]。然而,线粒体标志物、含量和生物发生在整个一天中没有变化[72]。
观察到的能量消耗昼夜节律可能是由于能量消耗的餐后成分。更多的试验[59,118,119]比没有[113,120]报告餐后能量消耗的昼夜变化:食物的热效应(TEF)在早上相对于下午晚些时候和晚上高出44%; 然而,早晨和下午早些时候的值没有差异[121]。然而,只有两项试验试图确定TEF中的这种昼夜节律是否由昼夜节律系统引起[113,119]。 一项使用 CA/M 方案的试验发现,餐后 TEF 的昼夜变化完全由内源性昼夜节律系统驱动,行为周期没有贡献;与生物晚相比,生物早晨的TEF高50%[119]。另一项试验使用CR方案和每113小时等热量零食,报告TEF无昼夜节律变化[<>]。然而,第二项研究的把握度可能不足,因为频繁的等热量零食体积小,使得更难辨别餐后能量消耗的昼夜节律变化,从而辨别TEF的变化;在此基础上,第一项研究的结论是TEF中存在昼夜节律,这更有可能是正确的。
除了餐后能量消耗外,餐后底物氧化也可能受到昼夜节律的控制。一项纳入13例健康成人的CA/M方案试验报道,早晚生物餐后RQ变异2%,餐后碳水化合物氧化变异10%,但脂肪氧化无变异[64]。相比之下,空腹状态下的静息能量消耗和底物氧化均不受一天中时间的影响[59,64,119-122],只有一项试验报告了例外[72]。
最后,昼夜节律系统也可能在调节食欲方面发挥作用。采用FD和CR方案的试验发现,自我报告的饥饿感在晚上达到高峰[86,123-125],20项试验报告在~00:17h出现肢端,峰谷幅度为123%[126]。然而,一项采用FD方案的试验发现,这并不能转化为食物摄入的昼夜节律[4]。相比之下,关于能量平衡激素的数据表明,它们是由食物摄入量而不是昼夜节律系统调节的。最初,一项使用CR方案的试验报道,6例患者中有21例存在瘦素昼夜节律,这4例患者的峰谷幅度为83%[24]。在一项昼夜研究中获得了相同的相对振幅,在00:127 h达到顶峰[6];然而,同一项昼夜调查测试了5.127小时的进餐班次,发现瘦素水平与生物钟有关,而是与进餐时间有关[18]。事实上,最近一项使用FD方案的试验发现瘦素中没有明显的昼夜节律[58]。同样,急性饥饿激素ghrelin的水平不受一天中时间的影响,但受睡眠,习惯性进餐时间和餐后葡萄糖水平的影响[128,<>]。
总的来说,这些试验表明,昼夜节律系统调节24小时和餐后的能量消耗以及主观食欲,但它不影响静息能量消耗,食物摄入量,生长素释放肽或瘦素。关于底物氧化的昼夜节律调节的数据仍然存在矛盾,需要进一步研究。
3. 昼夜节律失调和翻译意义
新陈代谢中的昼夜节律不仅受昼夜节律系统的驱动,还受环境和行为因素的驱动,包括光线、睡眠、食物摄入和身体活动。越来越多的证据表明,当这些外部节律与内源性昼夜节律不同步时,例如夜间暴露在强光下、白天睡觉或晚上进食(图4)—新陈代谢的几个方面受损。在这里,我们回顾了由三个外部因素(光照,睡眠和食物摄入)的错误时机引起的昼夜节律失调影响代谢健康的证据(总结为表1).对于睡眠和食物摄入,我们纳入的试验仅通过实验改变外部因素的时间(而不是持续时间),以避免睡眠不足或每日间歇性禁食(例如,限时进食)造成的任何混杂效应。因此,我们将综述限制在每日禁食时间和睡眠持续时间不变的试验中。
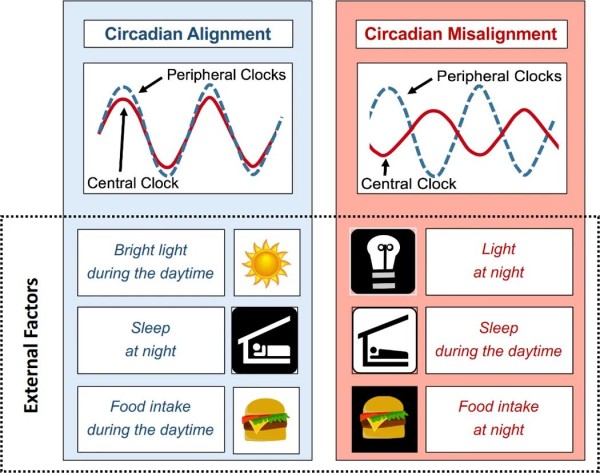
图4昼夜节律对齐与错位
上图是中央和外围时钟之间的昼夜节律对齐(左图)与未对准(右图)的示意图。白天的强光照射、白天的食物摄入和生物夜间的睡眠促进了中央和周边时钟之间的昼夜节律对齐。相反,晚上/晚上的光照或食物摄入,或白天睡觉,会使两个时钟系统错位并导致代谢功能障碍。
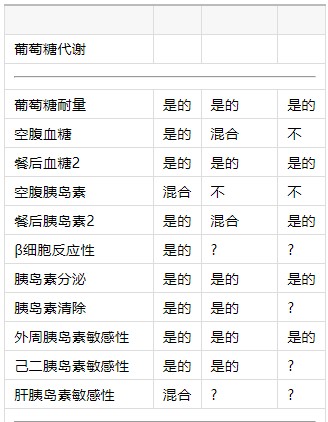
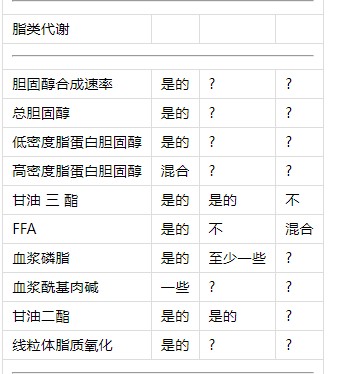
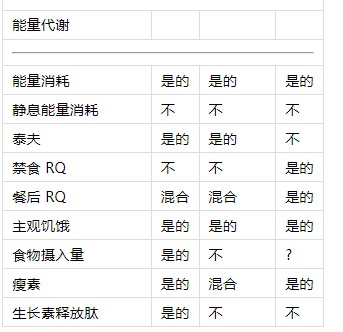
表1昼夜节律系统对人类新陈代谢的已知影响。
1昼夜节律?生理节律?受到错位的影响?
在单独的窗口中打开
1“?”表示昼夜节律系统的影响未知,而“混合”表示数据相互冲突。
2关于葡萄糖和胰岛素中昼夜节律存在的数据(根据CR方案确定)包含在餐后葡萄糖和胰岛素中。
3.1. 光
光是中央时钟的主要时代精神,暴露在强光下的时间、强度和持续时间都与代谢健康有关。
3.1.1 (不)白天曝光充足
白天的
强光照射会增加夜间褪黑激素的分泌[129-134],因此白天明亮光线不足可能会减弱中央时钟的节律,从而损害新陈代谢。例如,一项随机对照试验发现,白天将光照从5,000lux急性降低至80lux会抑制胃活动[135]。相反,一些试验报告说,早晨亮光疗法可以改善碳水化合物的新陈代谢和脂肪减少。(除非另有说明,否则所有代谢评估均在早上进行。在胰岛素依赖型糖尿病患者的两个案例研究中,日间亮光疗法数周减少了胰岛素需求[136,137],表明它可以改善血糖控制。早晨暴露于亮光疗法(1,300-5,000勒克斯)3-20周也可以降低胰岛素抵抗[138]、体重和/或脂肪量[138-142]、食欲[140],并可增加超重成人运动引起的瘦体重增加[138]。有趣的是,早晨暴露于特定波长的红、绿或蓝光(60lux)一周也可能有助于缓解睡眠剥夺引起的瘦素和生长素释放肽紊乱[143]。然而,并非所有研究都报道早晨强光照射有益:一项RCT发现,早晨单次4000勒克斯光照5小时会使糖尿病男性的血糖恶化,但对健康男性则没有[144]。糖尿病患者昼夜节律的异常(在第2.1.1节中讨论)或交感神经系统活动的急剧增加可以解释这些不同的影响。
3.1.2 错位
除了白天暴露在强光下不足外,晚上或晚上的光线也与代谢紊乱的风险增加有关。RCT报道,相对于昏暗的光线(<500-600勒克斯),夜间急性暴露于强光(>1-2勒克斯)会增加胰岛素抵抗,并升高餐后胰岛素、葡萄糖和GLP-5水平[145,146]。另一项RCT报道,夜间急性暴露于2,000勒克斯光会损害碳水化合物消化,如呼吸中呼出的氢气量所示[147],夜间急性暴露于富含蓝光(370lux)会增加餐后血糖峰值水平[148]。流行病学证据还表明,夜间或夜间强光暴露会增加代谢性疾病的风险。一项纳入了100万多例女性的横断面分析发现,睡眠时室内光线较亮与较高的BMI、腰围和腰臀比密切相关[000]。此外,一项前瞻性队列研究发现,与在昏暗光线下(<149勒克斯)睡眠的人相比,夜间暴露在光线下(≥3勒克斯)的老年人在10年内BMI增加了10%[150],甘油三酯和低密度脂蛋白胆固醇更高[151],HDL胆固醇更低[151]。此外,夜间光照增加(3-18勒克斯)与糖尿病患病率增加38%相关[51],而暴露于152勒克斯以上的光线每小时相位延迟与500.1kg/m相关。2BMI升高[153]。一项研究报道,光照时间解释了35%的BMI水平差异[153]。
3.2. 睡眠时间
睡眠时间的相移 - 即使睡眠持续时间保持不变 - 也会引起昼夜节律失调,导致代谢功能障碍。
3.2.1 葡萄糖和脂质代谢
使用睡眠阶段提前9小时模拟夜班工作的初步研究表明,不合时宜的睡眠会使葡萄糖和血脂水平恶化[19,20]。一项试验报道,日间睡眠使血糖和胰岛素AUC分别增加了12%和39%,餐后晚期甘油三酯和FFA水平升高,但对GLP-1没有影响[19]。然而,一项采用类似方案的随访试验发现,对葡萄糖、胰岛素、甘油三酯和FFA的影响是短暂的,在重新适应习惯性睡眠时间20日后完全(或几乎全部)消失[12]。最近采用更严格方案的研究报告了昼夜节律失调对葡萄糖和脂质代谢的明显影响。Scheer等人使用FD方案,发现睡眠(以及姿势周期、体力活动、膳食等)延迟6小时引起的昼夜节律失调使日均血糖水平恶化22%,胰岛素水平恶化18%,提示胰岛素敏感性受损,但没有足够的β细胞补偿[11]。餐后三小时的葡萄糖值在三餐中升高了21-38%(早餐的数值高于午餐和晚餐),八分之三的研究参与者(12%)在未对齐的条件下具有糖尿病前期或糖尿病的葡萄糖耐量值,但未对齐。然而,错位并不影响空腹血糖水平。Morris等人后来通过CA/M方案进行的睡眠相位延迟64小时的试验报告了定性相似的发现[24]。昼夜节律失调使2小时葡萄糖和胰岛素AUC分别增加了9%和2%。在餐耐量试验期间,错位也使 6 小时葡萄糖 AUC 增加了 14%,餐后晚期胰岛素 AUC 增加了 3%,但空腹血糖、空腹胰岛素和早期胰岛素 AUC 不受影响。从机制上讲,胰岛素敏感性降低对葡萄糖耐量紊乱的贡献大于β细胞功能受损。错位还使空腹和餐后RQ分别降低了2%和15%,有利于增加脂肪氧化,而禁食时碳水化合物氧化为代价,并使空腹FFA水平提高24%;然而,它不影响平均2小时FFA或甘油三酯水平或餐后47小时FFA水平。昼夜节律失调也会加剧睡眠不足对胰岛素敏感性的不利影响:在CA/M方案中,昼夜节律错位使胰岛素敏感性相对于对齐组恶化(-34% vs -154%),但不影响胰岛素分泌、体重或食物摄入[<>]。
3.2.2 能量代谢
白天的睡眠还可以减少能量消耗并改变底物氧化。McHill等人使用CA/M方案,睡眠相位延迟9小时,并报道受试者白天睡觉时燃烧的卡路里比晚上睡觉时少12-16%[21]。这反过来又转化为3小时能量消耗减少24%,从而提供了一种机制,至少可以部分解释夜班工人的体重增加。白天睡觉也使脂肪氧化增加了18%,碳水化合物和蛋白质氧化分别减少了20%和10%,至少在错位的第二天是短暂的。此外,错位减少了主观饥饿感,尽管肽YY和瘦素也分别降低了11-13%和35-41%。另一项使用FD方案的试验证实了后一种效应,该试验观察到在错位条件下,平均每日瘦素水平抑制了17%[18]。然而,生长素释放肽[21],静息代谢率[119]和TEF [21,119]均不受昼夜节律失调的影响。
3.3. 食物摄入量
进餐时间
一些试验报告说,延迟食物摄入时间的相位会产生不利的代谢后果——即使食物摄入量仅限于白天。将午餐时间从13:00 h改为16:30,可使空腹状态下的葡萄糖增量AUC增加46%,空腹(但不是餐后能量消耗)减少4%,碳水化合物氧化减少[155]。令人惊讶的是,晚午餐也钝化了昼夜皮质醇节律。另一项试验报道,晚餐时间从19:00 h到22:30 h的急性变化使第二天早上晚餐和早餐后的5小时葡萄糖AUC增加了7%-8%,24小时葡萄糖水平增加了4mg/dl,但不影响24小时能量消耗[156]。进餐时间延迟数小时也会显著增加振幅并改变胆固醇合成节律的相位[105],并改变相位,但不改变瘦素节律的平均24小时值[127]。最近,一项优雅的研究调查了在CR方案期间测量的延迟进餐时间延迟5小时(维持125日)对葡萄糖和胰岛素昼夜节律的影响[5]。虽然进食后期将葡萄糖节律延迟了7.24小时,但胰岛素,甘油三酯,皮质醇,褪黑激素和主观饥饿感的节律不受影响。然而,令人惊讶的是,在CR方案中,晚食使平均5小时葡萄糖水平降低了<>%,而没有改变葡萄糖节律的幅度;为什么会发生这种情况尚不清楚。
此外,四项试验调查了在一天中的不同时间吃一顿饭3-18天对能量代谢的影响。与早上(18:00小时)吃同一餐相比,晚上吃一顿饭(10:00小时)改变了底物氧化的昼夜节律,以碳水化合物氧化为代价增加了脂肪氧化[116,117,157]; 然而,18日后体重减轻[116,157]或3日后能量消耗的昼夜节律模式没有差异[117]。
两餐之间的热量
分布
改变两餐之间卡路里的分布 - 即使进餐时间没有改变 - 也会影响代谢风险因素。一项RCT纳入了中午前摄入70%卡路里的超重女性在0周内减掉的体重,比晚食女性在下午中午(6:6及以后)摄入70%的每日热量时多减16.30kg[158]。一项单日试验报道,20%的卡路里在早餐(60:09小时)而不是晚餐(30:20小时)摄入时,30小时葡萄糖AUC较低,胰岛素敏感性略高,而甘油三酯和FFA水平未受影响[159]。长期研究报告了更大的影响。一项为期20周的减肥试验纳入了420例受试者,尽管在自我报告的食物摄入量、早餐或晚餐时间、能量消耗或睡眠方面没有差异,但在15:00h前吃午餐的人比2:15h后吃午餐的人比基线体重减轻了00%[160]。两项针对肥胖女性[3]或多囊卵巢综合征女性[161]的162个月RCT报告,在等热量比较中,当受试者在早餐时摄入50-54%的卡路里时,而不是在晚餐时间摄入7-8%的卡路里时,葡萄糖耐量更好。在这两项研究中,大型早餐组的空腹血糖降低了22-53%;空腹胰岛素降低7-20%;葡萄糖AUC降低28-42%;胰岛素AUC降低161-2%;胰岛素敏感性指数相应更高。在其中一项试验中[5],超重女性体重减轻了34.15倍,甘油三酯显著降低(-161% vs 大型晚餐组为+3%),但生长素释放肽水平较低,主观饥饿感较低[1]。一项针对糖尿病患者的类似0个月RCT发现,与等热量饮食搭配大餐相比,食用富含蛋白质和脂肪的大量早餐可使血红蛋白A32c水平额外降低163.164%,并降低降高血糖药物剂量和饥饿评分[80]。然而,另一项针对糖尿病成人的试验报道,当受试者在晚餐时间摄入大部分卡路里时,他们的日间胰岛素分泌较低,而血糖水平和夜间胰岛素分泌保持不变[<>]。晚餐时间摄入大部分热量时胰岛素分泌减少,可能是糖尿病成人晚上肝葡萄糖产生减少所致[<>]。
讨论
尽管人类对代谢的昼夜节律调节不如啮齿动物那么明显,但有明确的证据表明,昼夜节律在新陈代谢的多个方面,包括葡萄糖、胰岛素、葡萄糖耐量、血脂水平、能量消耗和食欲。葡萄糖代谢的节律似乎是由多种代谢途径的昼夜变化驱动的,包括外周胰岛素敏感性、β细胞反应性、胰岛素清除率和葡萄糖有效性。同样,脂质节律受脂质合成、转运和分配的昼夜变化的影响。能量消耗和食欲也表现出昼夜节律,尽管数据表明这些节律不是由生长素释放肽或瘦素驱动的,并且缺乏潜在机制的证据。总的来说,这些数据表明昼夜节律系统在调节人类的新陈代谢方面起着普遍的作用,就像在啮齿动物中一样。
尽管如此,许多研究对这些节律的振幅和/或肢端相位并不一致。很可能,许多差异可以通过实验设计的差异以及外部或行为因素的控制来解释。例如,在检查葡萄糖代谢的节律时,葡萄糖负荷是口服还是静脉注射可能会影响节律的大小和存在。作为第二个例子,参与者是否睡眠和延长的清醒期的持续时间在CR和FD方案之间有所不同,这可能会对稳态睡眠驱动产生不同的影响并导致不同的代谢结果。然而,目前还没有一致的方法来调和这些方法论差异,或区分由昼夜节律系统驱动的节律与其他即使在外部刺激去除后也可能持续数天的瞬时节律。观察到的差异也可以用小样本量来解释,因为大多数昼夜节律研究涉及10个或更少的人类受试者。另一种解释是可能存在不同的昼夜节律代谢表型。数据已经表明存在基于性别的差异,2型糖尿病患者缺乏葡萄糖耐量或葡萄糖耐量节律倒置[34,35,62];此外,一天中脂质种类的肢端聚集表明不止一种昼夜节律表型[110,111]。无论如何,这些差异需要在未来的大型临床试验中得到调和。脂质代谢尤其值得进一步研究,因为脂质比任何其他血浆代谢物组都受到昼夜节律系统更广泛的调节,但来自昼夜和昼夜节律试验的数据尤其多样化。
尽管如此,证据似乎正在趋同,许多合成代谢节律在人类的生物学早晨或下午早些时候达到顶峰。例如,葡萄糖耐量较低,骨骼肌脂肪酸氧化和食物的热效应在早上高于晚上或晚上,这意味着白天早些时候是食物摄入的最佳选择,夜间是睡眠和禁食的最佳选择。事实上,通过在白天将食物摄入量转移到更早来与这些节律保持一致的饮食似乎可以改善成人的血糖控制并促进体重减轻,但需要进一步的良好对照研究来证实这些初步结果[155,156,158,160-162]。 有趣的是,这些益处可能主要是由餐后代谢途径的昼夜节律变化驱动的 - 特别是那些涉及骨骼肌和脂肪组织等外周组织的途径 - 这些途径似乎比在禁食状态下活跃的途径受到更大的昼夜节律调节。在未来,重要的是要阐明哪些器官和组织是这些全身代谢节律的最重要贡献者,以及确定潜在的分子机制,例如循环因子与细胞内介质的相对贡献。
重要的是,昼夜节律的紊乱会损害新陈代谢并影响代谢性疾病的发病机制。人类的证据现在清楚地表明,由不合时宜的光照、睡眠或食物摄入引起的昼夜节律失调都会恶化血糖控制,并对涉及能量平衡和体重减轻的因素产生不利影响,增加患糖尿病和肥胖症的风险。此外,效应量很大:例如,昼夜节律失调的急性发作可使餐后血糖水平增加11-21%[18],这表明维持昼夜节律对齐对代谢健康非常重要。然而,未来的研究需要确定改善昼夜节律排列或影响昼夜节律系统的干预措施是否确实可以预防或逆转代谢疾病。
总体而言,昼夜节律系统、新陈代谢和行为之间的这些相互关系强调了研究昼夜节律调节代谢的重要性。因此,需要进一步的研究来更好地了解昼夜节律系统如何与外部因素以及衰老和疾病过程相互作用,以预防和治疗糖尿病、肥胖症和高脂血症。
确认
资金来源的作用:EP得到了意大利罗马Sapienza大学的AR7 / 2016赠款支持。CMP得到了美国国立卫生研究院国家转化科学促进中心的KL2TR001419的支持。此内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。资金来源没有参与研究的任何方面。Poggiogalle E, Jamshed H, Peterson CM. Circadian regulation of glucose, lipid, and energy metabolism in humans. Metabolism. 2018 Jul;84:11-27. doi: 10.1016/j.metabol.2017.11.017. Epub 2018 Jan 9. PMID: 29195759; PMCID: PMC5995632.
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
网址:人类葡萄糖、脂质和能量代谢的昼夜节律调节 https://www.yuejiaxmz.com/news/view/433059
相关内容
科学网—肝脏昼夜节律驱动的进食行为中国科大揭示光感知调控血糖代谢的神经机制
Cell子刊:肠道菌群通过昼夜节律调节身体对压力的反应
昼夜节律抗衰新纪元:瑞士NyxSeren引领全球保健品行业新潮流
干红葡萄酒的功效 喝干红葡萄酒有什么作用
Nature :解读生物节律密码,有效抵抗衰老
影响睡眠的两大因素:昼夜节律&睡眠压力
葡萄和提子的区别
为什么有规律的生活可以预防脂肪肝
健身小秘诀 健身前吃点葡萄干补充运动能量

