漂白粉在社会生活.工业生产中用途广泛.它除了具有漂白作用外.还能杀菌消毒.(1)漂白粉的主要成分为CaCl2.Ca(ClO)2.工业上制取漂白粉的反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.(2)漂白粉长期暴露在空气中会逐渐失效.写出该过程中发生的化学方程式Ca(ClO)2+CO2+H2O=CaCO3+2HClO.2HCl 题目和参考答案——青夏教育精英家教网——
1.漂白粉在社会生活、工业生产中用途广泛,它除了具有漂白作用外,还能杀菌消毒.
(1)漂白粉的主要成分为CaCl2、Ca(ClO)2,工业上制取漂白粉的反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)漂白粉长期暴露在空气中会逐渐失效,写出该过程中发生的化学方程式Ca(ClO)2+CO2+H2O=CaCO3+2HClO,2HClO光照_" role="presentation">光照_ 2HCl+O2↑.
(3)工业上制取氯气的化学方程式为2NaCl+2H2O通电_" role="presentation">通电_2NaOH+Cl2↑+H2↑
实验室制取氯气的化学方程式为MnO2+4HCl(浓)△_" role="presentation">△_MnCl2+Cl2↑+2H2O.
分析 (1)工业上制备漂白粉是利用石灰乳和氯气反应生成氯化钙、次氯酸钙和水,漂白粉成分为氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙;
(2)漂白粉长期暴露在空气中会逐渐失效,是因为次氯酸钙和空气中的二氧化碳、水反应生成碳酸钙沉淀和次氯酸,次氯酸见光分解生成氧气和盐酸;
(3)工业制备氯气是利用电解饱和食盐水的方法得到,实验室中是利用固体二氧化锰和浓盐酸加热反应生成.
解答 解:(1)工业上制备漂白粉是利用石灰乳和氯气反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉成分为氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙,
故答案为:CaCl2,Ca(ClO)2;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)漂白粉长期暴露在空气中会逐渐失效,是因为次氯酸钙和空气中的二氧化碳、水反应生成碳酸钙沉淀和次氯酸,Ca(ClO)2+CO2+H2O=CaCO3+2HClO,次氯酸见光分解生成氧气和盐酸,2HClO光照_" role="presentation">光照_2HCl+O2↑,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO;2HClO光照_" role="presentation">光照_2HCl+O2↑;
(3)工业制备氯气是利用电解饱和食盐水的方法得到,反应的化学方程式为:2NaCl+2H2O通电_" role="presentation">通电_2NaOH+Cl2↑+H2↑,实验室中是利用固体二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓)△_" role="presentation">△_MnCl2+Cl2↑+2H2O,
故答案为:2NaCl+2H2O通电_" role="presentation">通电_2NaOH+Cl2↑+H2↑;MnO2+4HCl(浓)△_" role="presentation">△_MnCl2+Cl2↑+2H2O.
点评 本题考查了氯气及其化合物性质、氯气制备和漂白粉制备原理等知识点,主要是化学方程式书写,掌握基础是解题关键,题目较简单.
练习册系列答案
相关习题
科目:高中化学来源:题型:选择题
11.化学试剂不变质和实验方法科学是化学实验成功的保障.下列试剂保存方法或实验方法中,不正确的是( )
A.保存FeCl2溶液时,通常在溶液中加少量的单质铁B.常温下,浓硝酸可以用铁罐车贮运C.可用湿润的蓝色石蕊试纸检验氨气D.除去CO2中混有的HCl,可通过盛有饱和NaHCO3溶液的洗瓶查看答案和解析>>
科目:高中化学来源:题型:多选题
12.黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①2Cu2O+Cu2S→6Cu+SO2…②.则下列说法正确的是( )
A.反应②中Cu2S只发生了氧化反应B.反应①中氧化产物只有SO2C.若1molCu2S完全转化为2molCu,则转移电子数为2NAD.将1molCu2S冶炼成2molCu,需要O21mol查看答案和解析>>
科目:高中化学来源:题型:选择题
9.明末清初著名的科学家宋应星在其《天工开物》某条目下写道:“凡石灰经火焚炼为用.…百里内外,土中必生可燔石,石以青色为上,黄白次之.石必掩土内二三尺,掘取受燔,土面见风者不用.”其中的“可燔石”是指( )
A.黏土B.纯碱C.石灰石D.熟石灰查看答案和解析>>
科目:高中化学来源:题型:解答题
16.铜是与人类关系非常密切的常见金属.
Ⅰ.已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+=Cu2++Cu.
(1)CuH中H元素化合价为-1.
(2)目前制备纳米级Cu2O的一种方法:在氢氧化铜悬浊液中滴入N2H4•H2O水溶液,充分反应后即可得到Cu2O,同时产生无色无味的气体.上述制备过程中总反应的化学方程式为4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O.
(3)一定条件下,在CuSO4中加入NH4H反应生成氢化亚铜(CuH).将CuH溶解在足量稀硫酸中,当产生6.72L H2(标准状况下)时,参加反应的硫酸的物质的量为0.15mol.
Ⅱ.孔雀石呈绿色,是一种名贵的宝石.其主要成分是xCu(OH)2•yCuCO3.某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验: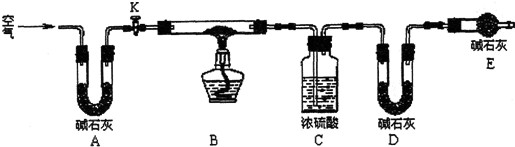
步骤1:检查装置的气密性,将研细的样品置于硬质玻璃管中.
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:打开K1,继续通一段时间空气至装置冷却.
步骤5:冷却至室温,称量相关装置的质量.
(1)请补充步骤4操作内容:打开K1,继续通一段时间空气至装置冷却.
(2)若无装置E,则实验测定的x/y的值将偏小(选填“偏大”、“偏小”或
“无影响”).
(3)某同学在实验过程中采集了如下数据:
A.反应前硬质玻璃管与样品的质量163.8g
B.反应后硬质玻璃管中残留固体质量20g
C.装置C实验后增重2.25g
D.装置D实验后增重5.5g
为测定x/y的值,你认为可以选用上述所采集数据中的BC、BD、CD (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式Cu(OH)2•CuCO3.
查看答案和解析>>
科目:高中化学来源:题型:选择题
6.下列离子能够大量共存的是( )
A.Mg2+、K+、SO42-、NO3-B.Ba2+、Mg2+、SO42+、Cl-C.OH-、K+、Na+、H+D.H+、K+、Cl-、CO32-查看答案和解析>>
科目:高中化学来源:题型:选择题
10.实验室欲配制2L 0.5mol•L-1 NaCl溶液,不必用到的仪器是( )
A.量筒B.天平C.容量瓶D.烧杯查看答案和解析>>
科目:高中化学来源:题型:解答题
11.溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末.制备CuBr的实验步骤如下:
步骤1.在如图所示的三颈烧瓶中加入45gCuSO4•5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时.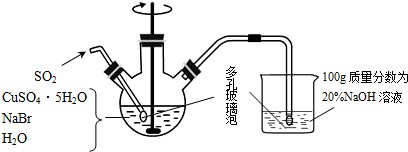
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤.
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤.
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥.
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去其中水中的O2(写化学式).
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为2Cu2++2Br-+SO2+2H2O=2CuBr↓+SO42-+4H+;②控制反应在60℃进行,实验中可采取的措施是60℃水浴加热;③说明反应已完成的现象是溶液蓝色完全褪去.
(3)步骤2过滤需要避光的原因是防止CuBr见光分解.
(4)步骤3中洗涤剂需“溶有SO2”的原因是防止CuBr被氧化;最后溶剂改用乙醚的目的是除去表面乙醇,并使晶体快速干燥.
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3•7H2O晶体.
请补充实验步骤 须用到SO2(贮存在钢瓶中)、20%NaOH溶液、乙醇:
①在烧杯中继续通入SO2至饱和.②然后向烧杯中加入100g20%的NaOH溶液.③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶.
④过滤,用乙醇洗涤2~3次.⑤放真空干燥箱中干燥.
查看答案和解析>>
网址:漂白粉在社会生活.工业生产中用途广泛.它除了具有漂白作用外.还能杀菌消毒.(1)漂白粉的主要成分为CaCl2.Ca(ClO)2.工业上制取漂白粉的反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.(2)漂白粉长期暴露在空气中会逐渐失效.写出该过程中发生的化学方程式Ca(ClO)2+CO2+H2O=CaCO3+2HClO.2HCl 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/46607
相关内容
“低碳生活 既是时尚.也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.(1)在汽车排放气装置中安装一个净化器可以有效地处理汽车有毒尾气.如:CO(g)+HO2+CO2(g)△H=下列是生活中常见物质的pH,其中碱性最强的是( )A.厕所清洁剂pH=1
个人卫生及消毒注意事项
低碳生活是一种时尚的生活理念.倡导人们降碳节能.有效幵发利用CO2.(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为.H2应从电解池的 通入,其中b电极的电极反应方程式为 .(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛.当时.制备反应分两步进行.其中一步是.则另一步是 .的HCHO可用于杀菌消毒.其原因是 . 题目和参考答案——青夏教育精英家教网——
小苏打在日常生活中有广泛的用途.工业上制取小苏打有多种方法.其中有一种是气相固碳法.其利用的原理是:Na2CO3+H2O+CO2=2NaHCO3资料1:NaHCO3+NaOH=Na2CO3+H2O资料2:碳酸钠和碳酸氢钠的溶解度表温度/℃0152030405060碳酸氢钠溶解度/g6.98.729.611.112.714.4516.4碳酸钠溶解度/g7.713.2521.839.74 题目和参考答案——青夏教育精英家教网——
能让你白手起家的5大暴利创业项目
铜及其化合物在工业生产和日常生活中有着广泛的应用。(1)Li
2021年日常生活安全知识竞赛题库及答案(共100题)
C+H2O ==== CO+H2.该反应中氢元素的化合价变化为+1→0.碳元素的化合价的变化为 .(2)过程Ⅲ中发生化合反应的化学方程式为 .(3)将煤加工处理的意义是 . 题目和参考答案——青夏教育精英家教网——
环保小制作简单又漂亮

