科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH
科学实验和人类的生活经验告诉我们,化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:
(1)离子反应H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1表示在稀溶液中,强酸和强碱反应生成1molH2O(1),这时的反应热叫做中和热.在中和热的测定实验中,下列溶液组合最合适的是
.
A.25mL0.4mol?L-1盐酸溶液与25mL0.4mol?L-1氨水
B.25mL0.4mol?L-1盐酸溶液与25mL0.45mol?L-1NaOH溶液
C.25mL0.4mol?L-1H2SO4溶液与25mL0.8mol?L-1NaOH溶液
D.25mL0.4mol?L-1H2SO4溶液与25mL0.45mol?L-1NaOH溶液
(2)写出稀H2SO4溶液与稀NaOH溶液发生反应,表示中和热的热化学方程式:
(3)已知CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1当1molCH4(g)与2molO2(g)的总能量之和是3048kJ,则1molCO2(g)与2molH2O(l)的总能量之和是
kJ.
试题答案在线课程考点:反应热和焓变,中和热,热化学方程式
专题:化学反应中的能量变化
分析:(1)弱酸或弱碱的电离吸热,会导致测得反应热的数值偏小;盐酸和氢氧化钠溶液的用量只要满足氢氧化钠溶液稍过量,保证氢离子完全反应;
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(3)根据△H=生成物的总能量-反应物的总能量计算.
解答: 解:(1)A、氨水电离过程需要吸热,会导致测得反应热的数值偏小,故A不合适;
B、盐酸提供的氢离子为0.010mol,氢氧化钠溶液提供的氢氧根离子为0.01125mol,碱稍过量,故B合适;
C、硫酸溶液提供的氢离子与氢氧化钠溶液提供的氢氧根离子的物质的量相等,不能保证氢离子完全反应,故C不合适;
D、硫酸溶液提供的氢离子为0.020mol,氢氧化钠溶液提供的氢氧根离子为0.01125mol,氢离子不能完全反应,故D不合适;
故答案为:B;
(2)由H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1可知:H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,
反应的热化学方程式为H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
(3)1molCO2(g)与2molH2O(l)的总能量之和=-890kJ+3048kJ=2158kJ,
故答案为:2158.
点评:本题考查了中和热的测定、中和热热化学方程的书写以及焓变的计算,题目难度不大,注意中和热测定实验中一般要求氢氧化钠溶液稍过量,因为在实验条件下,盐酸比氢氧化钠溶液稳定.
练习册系列答案
相关习题
科目:高中化学来源:题型:
完全相同的两个密闭容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2、O2各2克,在同一温度下反应,2SO2(g)+O2(g)?2SO3(g)达平衡后,甲中SO2的转化率为a%,乙中SO2的转化率为b%,则( )
A、a%>b%B、a%<b%C、a%=b%D、无法判定查看答案和解析>>
科目:高中化学来源:题型:
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.
I.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相关的化学反应方程式为:
.
(2)装置B是安全瓶,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象
.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入
.(选a或b或c)
abcI干燥的有色布条湿润的有色布条湿润的有色布条II碱石灰浓硫酸无水氯化钙III湿润的有色布条干燥的有色布条干燥的有色布条(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是
.该现象不能说明溴的非金属性强于碘,原因是
.
(5)①如果向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.该反应的离子方程式为
,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.该反应的离子方程式为
.
②把KI换成KBr,则CCl4层变为
色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是
.
(6)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一.
①写出该反应的化学方程式:
.
②在该反应中,氧化剂是
,被氧化的元素是
.
③在反应中,每转移1mol电子,消耗HCl
mol.
查看答案和解析>>
科目:高中化学来源:题型:
将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)═2C(g)
反应进行到2s末,测得A为0.5mol,B为0.4mol,C为0.2mol.计算:分别用C浓度的增加、A和B浓度的减少来表示该反应的速率.
查看答案和解析>>
科目:高中化学来源:题型:
 (1)铁、铝、铜是人类使用广泛的三种金属.
(1)铁、铝、铜是人类使用广泛的三种金属.
①将铁和铜同时投入稀盐酸中,发生的变化如图所示.则B是
(填“铁”或“铜”).
②只用一种试剂验证铁、铝、铜的活动顺序,这种试剂是
(填字母序号)
A.FeSO4溶液 B.Al2(SO4)3溶液 C.CuSO4溶液
③铁在空气中容易发生锈蚀,为防止自行车的支架、链条等构件锈蚀,一般采用的方法是
(写一种).
(2)我市古田、寿宁等地盛产香菇,香菇的生产原料及配比如下表
①原料加水搅拌时温度升高,原因是生石灰与水发生了反应,反应的化学方程式为
,该反应
(填“放出”或“吸收”)热量.
②原料中属于磷肥的是
.
查看答案和解析>>
科目:高中化学来源:题型:
CO和H2可作为能源和化工原料,应用十分广泛.制取CO和H2的有关化学反应的能量变化如图3所示.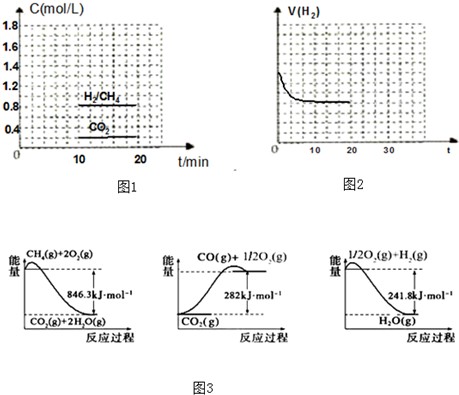
(1)写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式
.
(2)CO和H2可以合成二甲醚,化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H<0.
如果上述反应方程式的平衡常数K值变大,则该反应
(选填编号).
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g).
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的浓度如图1所示:用CH4表示达到平衡时的正反应速率
,起始充H2的物质的量为
,该温度下的平衡常数等于
.
②图2表示H2在建立平衡过程中的速率时间图,若现在20min时扩大容器体积,并在30min时又达到状态,请在图2中画出H2的逆反应方向速率时间图象.
查看答案和解析>>
科目:高中化学来源:题型:
 在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.
在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.
(4)上述反应的化学方程式为
.
(5)平衡时X的转化率
Y的转化率(填“>”、“<”或“=”,下同).
(6)在一容积可变的密闭容器中充入20mol X和10mol Y,Y的平衡转化率随温度(T)、压强(P)的变化如图所示,则p1、p2的大小关系为p1
p2.当达到平衡状态A时,容器的体积为10L;则在平衡状态B时,容器的体积为
L.
查看答案和解析>>
科目:高中化学来源:题型:
下表是周期表中的一部分,根据a-n在周期表中的位置,按要求回答问题:
族周期ⅠAⅡAⅢⅣAⅤAⅥAⅦA01a2bcde3fghijkmn(1)表中元素,只有负价而无正价的元素是
,氧化性最强的单质是
.(本小题均填物质的名称)
(2)最高价氧化物的水化物中碱性最强的是
,呈两性的是
,写出它与氢氧化钠反应的离子方程式
.(本小题均用化学式表示)
(3)在d、f、g、h中,原子半径从大到小的顺序为的是
.(用元素符号表示).
(4)比较k、m的气态氢化物的稳定性.
(用化学式表示)
(5)比较c、j的最高价氧化物的水化物酸性强弱
.(用化学式表示)
查看答案和解析>>
科目:高中化学来源:题型:
写出下列物质的电离方程式:
(1)H2CO3
(2)NaHSO4
(3)NH3?H2O
.
查看答案和解析>>
网址:科学实验和人类的生活经验告诉我们.化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:(1)离子反应H+(aq)+OH https://www.yuejiaxmz.com/news/view/68056
相关内容
金属在日常生活中应用广泛.(1)用锌片和硫酸铜溶液的反应可呈现“铁树开花 的美景.该反应的化学方程式是 .(2)铁制品在喷漆前需放入稀盐酸中除锈.除铁锈的化学方程式是 . Zn + CuSO4 === ZnSO4 + Cu Fe2O3 + 6HCl === 2FeCl3 + 3H2O [解析] (1)锌和硫酸铜反应生成硫酸锌和铜.反应的化学方程式是Zn + 题目和参考答案——青夏教育精英家教网——铁及其化合物在日常生活.生产中应用广泛.氯化铁和高铁酸钾都是常见的水处理剂.如图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程.请回答下列问题:(1)已知:①Fe2O3+3CO(g)△H=+489.0kJ•mol
已知:在氢氧化钠浓溶液中加入氧化钙.加热.制成的白色固体就是碱石灰.有两个实验小组的同学决定通过实验探究碱石灰的组成.(1)第一小组设计方案的流程如下:①写出n (OH
漂白粉在社会生活.工业生产中用途广泛.它除了具有漂白作用外.还能杀菌消毒.(1)漂白粉的主要成分为CaCl2.Ca(ClO)2.工业上制取漂白粉的反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.(2)漂白粉长期暴露在空气中会逐渐失效.写出该过程中发生的化学方程式Ca(ClO)2+CO2+H2O=CaCO3+2HClO.2HCl 题目和参考答案——青夏教育精英家教网——
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
白头鹎对季节性驯化和温度适应的生理反应
生活中若将洁厕灵和84消毒液混合使用.二者会发生反应.产生氧气.反应的化学方程式为2HCl+NaClO=NaCl+Cl2+H2O.(1)上述反应中.含氯元素化合价最高的物质是 .A.HCl B.NaClO C.NaCl D.Cl2 (2)自来水厂常用氯气对天然水进行杀菌消毒.在此之前还要经过沉降. 等净化操作.生活中降低水的硬度的常用� 题目和参考答案——青夏教育精英家教网——
如图是三种日常生活中常用的化工产品.请回答下列问题:的有效成分为过氧化氢.长期存放会失效.用化学方程式解释失效的原因2H2O2=2H2O+O2↑.含有盐酸.与“84 消毒液(图3)混合会发生如下反应:2HCl+NaClO═X+H2O+Cl2↑.对人体造成伤害.下列说法正确的是ABC.A.X的化学式为NaCl B.对人体造成伤害的物质是氯 题目和参考答案——青夏教育精英家教网——
“低碳生活 既是时尚.也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.(1)在汽车排放气装置中安装一个净化器可以有效地处理汽车有毒尾气.如:CO(g)+HO2+CO2(g)△H=
从樟科植物枝叶提取的精油中含有下列甲.乙.丙三种成分:(1)甲中含氧官能团的名称为羟基羟基.(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物.下同):反应Ⅱ的化学方程式为.(3)已知:RCH=CHR′ RCHO+R′CHO, 2HCHO HCOOH+CH3OH由乙制丙的一种合成路线图如下(A

