利用右图所示装置可吸收SO2.并用阴极排出的溶液吸收NO2.下列说法正确的是A.a为直流电源的负极B.阴极的电极反应式为:2HSO+2H++e
利用右图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
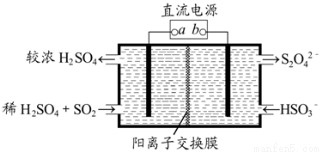
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO+2H++e-===S2O+2H2O
C.阳极的电极反应式为:SO2+2H2O-2e-===SO+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
试题答案在线课程C
【解析】
试题分析:A、二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极与电源正极a相连,故A错误;B、阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,故B错误;C、阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+,故C正确;D、阳离子交换膜只允许阳离子通过,电解时,阳离子移向阴极,所以H+由阳极室通过阳离子交换膜到阴极室,故D错误;答案选C。
考点:考查电化学原理的应用
练习册系列答案
相关习题
科目:高中化学来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版)题型:实验题
(14分)芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称
相对分 子质量
性状
熔点
沸点
密度
溶解度
水
乙醇
乙醚
甲苯
92
无色液体易燃易挥发
-95
110.6
0.8669
不溶
易溶
易溶
苯甲酸
122
白色片状或针状晶体
122.4
248
1.2659
微溶
易溶
易溶
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
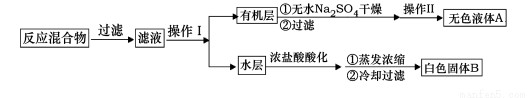
(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版)题型:填空题
(12分). A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式) ;E、F、L、I所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 。
(3)在10 L的密闭容器中,通入2 mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 KJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为: 。
查看答案和解析>>
科目:高中化学来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版)题型:选择题
近日来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作错误的是
A.运石油的油罐车上应贴 标志,装运浓硫酸的槽罐车应贴
标志,装运浓硫酸的槽罐车应贴 标志,并由专人押运
标志,并由专人押运
B.欲往燃烧的酒精炉中添加酒精必须要先熄灭酒精炉并等酒精炉完全冷却后才能加入酒精。
C.炒菜时油锅着火,立即加水灭火;电器起火时,应立即切断电源并采取适当措施灭火。
D.若家中出现煤气泄露,会闻到浓烈的气味,应马上开窗通风,切不可打电话或打开其他电器。
查看答案和解析>>
科目:高中化学来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版)题型:选择题
某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42-等离子中的几种离子。
①取10mL该溶液于试管中滴加Ba(NO3)2溶液并加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
②另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,沉淀的量与所加氢氧化钠溶液体积如图所示
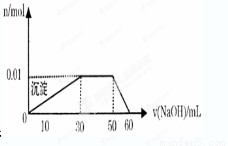
下列说法正确的是( )
A.溶液中一定存在的离子有K+、NH4+、Al3+、SO42-
B.溶液中一定不存在的离子有Cl-、Fe3+ 、Mg2+ 、K+、CO32-
C.实验中NaOH溶液的物质的量浓度为0.lmol/L
D.实验中无法确定K+的存在
查看答案和解析>>
科目:高中化学来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版)题型:选择题
下列图像表达正确的是( )
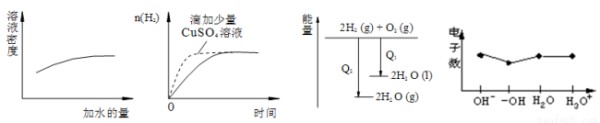
A.浓硫酸的稀释等量的锌粉反应 B.过量的盐酸与能量变化
C.氢气与氧气反应中的 D.微粒电子数
查看答案和解析>>
科目:高中化学来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版)题型:选择题
化学与生产、生活、社会密切相关。下列有关说法中,错误的是( )
A.今夏,我国许多地方出现了旱情,缓解旱情措施之一是用碘化银进行人工增雨
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济”
D.加酶洗衣粉去除蛋白质、油渍效果很好,可以用来洗涤毛织品、棉织品及化纤织品
查看答案和解析>>
科目:高中化学来源:2015届浙江省高三9月月考化学试卷(解析版)题型:选择题
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
查看答案和解析>>
科目:高中化学来源:2015届浙江省杭州市高三10月月考化学试卷(解析版)题型:填空题
(6分)已知A、B、C是常见的单质,在一定条件下相互转化的关系如右图所示(有部分物质省略)。
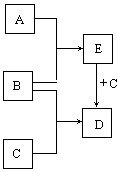
(1)若常温下,B为气体,A为红色固体,C元素在地壳中含量位于第三,E为黑色固体,写出C+E→D的化学方程式 。
(2)若常温下A、B均为气体,C为金属单质,D为黑色晶体,写出C+E→D的化学方程式 。
(3)若常温下B为气体,A为黑色非金属固体,C为金属,写出C+E→D的化学方程式 。
查看答案和解析>>
网址:利用右图所示装置可吸收SO2.并用阴极排出的溶液吸收NO2.下列说法正确的是A.a为直流电源的负极B.阴极的电极反应式为:2HSO+2H++e https://www.yuejiaxmz.com/news/view/46895
相关内容
下列有机物命名正确的是 A.CH2=CH低碳生活是一种时尚的生活理念.倡导人们降碳节能.有效幵发利用CO2.(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为.H2应从电解池的 通入,其中b电极的电极反应方程式为 .(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛.当时.制备反应分两步进行.其中一步是.则另一步是 .的HCHO可用于杀菌消毒.其原因是 . 题目和参考答案——青夏教育精英家教网——
“低碳生活 既是时尚.也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.(1)在汽车排放气装置中安装一个净化器可以有效地处理汽车有毒尾气.如:CO(g)+HO2+CO2(g)△H=
漂白粉在社会生活.工业生产中用途广泛.它除了具有漂白作用外.还能杀菌消毒.(1)漂白粉的主要成分为CaCl2.Ca(ClO)2.工业上制取漂白粉的反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.(2)漂白粉长期暴露在空气中会逐渐失效.写出该过程中发生的化学方程式Ca(ClO)2+CO2+H2O=CaCO3+2HClO.2HCl 题目和参考答案——青夏教育精英家教网——
青少年应该养成健康的生活方式,下列选项中属于健康的生活方式是( )
已知生活用品中厕所清洁剂的pH=1,厨房清洁剂的pH=12.下列说法错误的是()
如图所示为一列简谐横波沿
恒定电场的应用.doc
极昼与极夜:挪威人如何适应极端季节
阴道哑铃是拯救性生活的“神器”,怎么用才正确?手把手教你

