【专家视角】 丛枝菌根真菌-枯草芽孢杆菌组合体系对盐碱土壤微生态的修复作用
使用园艺专用的土壤改良剂,如微生物菌剂来增强土壤生物活性。 #生活技巧# #园艺种植技巧# #土壤调理方法#
新浪财经ESG评级中心提供包括资讯、报告、培训、咨询等在内的14项ESG服务,助力上市公司传播ESG理念,提升ESG可持续发展表现。点击查看【ESG评级中心服务手册】
丛枝菌根真菌-枯草芽孢杆菌组合体系对盐碱土壤微生态的修复作用
叶玢妤 1,俞 跃 1,何沛益 2,谢启晓 1,杨瑞滢 3,吴嘉睿 1,刘怡琳 1,林子然 1,赖威宇 1,许凌祎 1,刘 鹏 1,洪华嫦 3*
1.浙江师范大学生命科学学院,浙江 金华 321004;
2.浙江师范大学化学与材料科学学院,浙江 金华 321004;
3.浙江师范大学地理与环境科学学院,浙江 金华 321004
摘要:为缓解盐碱化对土壤微生态环境造成的危害,探究双菌组合体系对盐碱土壤微生态的修复作用,本文以中蔬四号番茄(Lycopersicon esculentum L.)品种为试验材料 , 丛枝菌根真菌 (AMF) 和枯草芽孢杆菌为试验菌剂 , 分别采用盆栽培养法和灌根法接种菌剂 , 通过盆栽实验 , 设 置15(SA1),75(SA2),150mmol/L(SA3)盐碱溶液浓度,探明外施 AMF 与枯草芽孢杆菌对盐碱胁迫下供试番茄土壤微生态环境的影响.AMF+枯草芽孢杆菌灭菌液(Gm)、AMF 灭菌物+枯草芽孢杆菌(B)组对盐碱土壤具有一定改善作用,而双菌处理(Gm+B)组具有更强的治理效果.双菌处理下,株高较空白对照组(CK1)增长最为显著,提高了 57.52%,较添加灭活菌液对照组(CK2)提高了 58.04%.Gm+B 组与对应浓度盐胁迫下 CK1相比,土壤有机质最高上升 47.15%,大于 Gm、B 组增幅,同时全氮(N),速效磷(P)和速效钾(K)含量显著提高,分别提升 38.85%(SA2+Gm+B)、465.20%(SA1+Gm+B)、和 157.75%(SA3+Gm+B).土壤脲酶、蔗糖酶和过氧化氢酶活性均于双菌处理下得到显著增强,分别提高了 63.64%(SA2+Gm+B)、209.63%(SA3+Gm+B)和 45.26%(SA3+Gm+B).土壤中细菌、真菌、放线菌数目最大增长幅度为 CK1的 1.93 倍(SA2+Gm+B)、1.25 倍(SA2+Gm+B)和 4.37 倍(SA3+Gm+B),根际微生物群落结构得到一定的改善.接种的两种生态功能菌群协同互作使盐碱土 pH 值和电导率降低,含水量显著增加.N、P、K 含量呈上升趋势,提高丛枝菌根真菌侵染率,削弱盐碱土壤对酶活性的损害程度,促进植物根茎发育.因此,丛枝菌根真菌-枯草芽孢杆菌组合体系具有对盐碱土壤微环境进行有效生态恢复的潜力.
关键词:AMF;枯草芽孢杆菌;盐碱胁迫;土壤微生态;修复作用
土壤盐碱化是影响全球农林业生产、发展和生态环境的重大问题,其过高的盐离子浓度主要通过渗透胁迫、离子毒害和氧化胁迫等方式对植物造成伤害,阻碍其生长[1].国内外相关报道指出,土体中盐碱成分占比较高,会导致其有机磷(P)、交换性钙(Ca)含量减少,pH 值、水解氮(N)等呈先降后升再降的趋势[2].同时,随着盐碱化程度加深,生物量显著降低,蔗糖酶、脲酶活性受到抑制[3].田间土壤微生物量碳和氮均随着土壤盐浓度的升高而逐渐下降,反映了盐分胁迫对土壤微生物具有显著的抑制效应,影响土壤微生物量及区系种群结构,减小其活性养分库[4].番茄(Lycopersicon esculentum L.)为茄科(Solanaceae)番茄属(Lycopersicon)草本植物,是我国重要食用和药用农产品之一,市场潜力突出.黄淮海、长江、西北等地为我国主要番茄产地,然而近年来,不合理施肥和灌溉引起的番茄种植区土壤次生盐渍化日益严峻[5],已成为制约我国番茄产业可持续高效发展的重要因素[6].基于此,寻找一种能够有效降低土壤盐碱化水平的方式,具有重要的经济与生态意义.
土壤根际微环境是土壤特殊微域之一,植物、微生物、土壤在此区域中进行互作[7].丛枝菌根真菌(AMF)能够与大多数陆生植物形成共生体,具有分泌有机酸、增强多种土壤酶活性、促进植株根系对土壤养分的转换及有效活化等多种功能[8-9].研究表明,AMF 能促进土壤养分的活化,显著影响林下植被群落组成并增加生物量[10],具有提高土壤 P 有效性,促进土壤中有效 N、P 向植物体内的转移,维持土壤N、P 平衡等功能[11].另有研究发现,Gm 接种能够增加土壤真菌群落的丰富度与多样性,提升土壤酶活性[13-14],且其在提高土壤有效磷和有效钾方面较根内球囊霉菌(Gi)更为显著[12].枯草芽孢杆菌(Bacillussubtilis Cohn)作为植物盐碱胁迫的理想促生菌,能够分泌有机酸,产生多种活性物质,改变土壤微生态结构,其分泌物可加速氮、磷、钾的释放,使土壤中脲酶、蛋白酶和蔗糖酶等活性加强,从而改变土壤养分 [15].实验表明,枯草芽孢杆菌不仅可提升甜瓜(Cucumis melo L.)生长指标(株高、茎粗、叶面积)[16],在盐碱土壤优化方面也有显著作用,如侯亚玲等[17]通过模拟土面蒸发试验和土壤持水性能试验,证明施加枯草芽孢杆菌后土壤累积蒸发量、蒸发速率以及土壤的含盐量均显著降低,表明枯草芽孢杆菌在优化土壤保水性能、改良盐碱地方面具有卓越贡献.
土壤和植物组织中的 AMF 和植物根际促生菌相互合作,通过增加营养、植物根系的菌丝渗透性、细菌存活以及抵御生物和非生物胁迫来促进植物生长,如来自微生物的信号被同源植物免疫受体感知以启动防御或共生反应[18].研究发现,AMF 和芽孢杆菌属不仅在促进植物生存方面存在协同效应,能够增强植物养分吸收、保护其免受病原体的侵害以及减轻其非生物胁迫[19],在修复污染土壤方面也有显著作用[20].但现今国内外学者多探索植物-微生物之间的关系,而对微生物改善土壤的研究较少,且主要采用单种生物菌剂缓解盐碱胁迫危害,有关AMF 和枯草芽孢杆菌互作修复盐碱地的探索少见相关报道.由此,本文在不同盐浓度胁迫下,设置AMF及枯草芽孢杆菌的单接种与双接种,探究两种促生菌的协同作用及联合防治成效,为其在盐碱土种植栽培作物的相关探索提供理论依据与技术支持,以期推动农业绿色发展和生态环境持续恢复.
1 材料与方法
1.1 实验材料
试验于 2022 年 6 月~2023 年 10 月在浙江师范大学植物学实验室进行.选取中蔬四号(ZhongshuNo. 4)番茄作为供试植物,供试真菌为摩西球囊霉菌(Glomus mosseae, Gm),购自长江大学园艺园林学院根系生物学研究所,ACCC 60429 枯草芽孢杆菌(Bacillus subtilis, B)购自中国农业微生物保藏管理中心.
1.2 实验设计
采用盆栽培养法[21],以红花三叶草为寄主植物扩繁 AMF,扩繁基质为红壤和河沙的混合物(1:1).种子经 3%双氧水消毒 5min 后,再使用无菌水反复冲洗.设 CK1(空白对照)、CK2(添加灭活菌液)、Gm(AMF+枯草芽孢杆菌灭菌液)、B(AMF 灭菌物+枯草芽孢杆菌)、Gm+B(AMF+枯草芽孢杆菌) 5 个接种处理.盆钵用 70%的酒精擦拭后晾干,每盆填充 2/3经高压蒸汽灭菌后的等量红壤和河沙的混合土壤,将 15g Gm 菌剂平铺其上,将消毒后的 20 粒种子均匀播种后再覆盖一层河沙,喷水湿润.于 23~28 , ℃ 光照 15h/d 培养一定生长期后,去除地上部分植物体,收获菌根化根段、土壤中的菌丝体和根围土壤组成的接种混合物[22].枯草芽孢杆菌菌株转移到牛肉膏蛋白胨液体培养基上,在 28℃下震荡培养 30h,稀释细菌悬浮液至浓度为 3×108cfu/mL[23].
选用菜园土和河砂,过 2mm 土壤筛,并于1×105Pa 下进行湿热灭菌[11,24].供试土壤为菜园土和河沙的混合土,pH 值 6.50、含水量 12.31%、电导率0.42mS/cm、有机质含量为 27.13g/kg、总氮含量1.32g/kg 、有效磷含量 12.17mg/kg 、有效 钾103.24mg/kg.根据预实验确定的盐碱浓度分别对番茄幼苗进行处理,用 Na2CO3和 NaHCO3配置浓度为15,75,150mmol/L 胁迫液(分别由 0.795,3.975 和7.95g/L Na2CO3与 0.63,3.15 和 6.3g/L NaHCO3 1:1配制,pH 值分别为 8.67、8.93、9.41).并在盐碱胁迫下设置添加无菌水的空白对照组(CK1)、添加灭活菌液的对照(CK2)和接种不同组合菌剂的实验组,即组合成分设定为丛枝菌根真菌、枯草芽孢杆菌和丛枝菌根真菌+枯草芽孢杆菌.如表 1 所示,设不接种的 6组对照和 9 组处理,每个处理设 3 次重复.
将灭菌后的混合土壤装盆 1/2(约 3kg,盆口径23cm,底径 18cm,高 22cm),浇盐碱水湿透,覆盖 5000接种势单位(IPU) AMF 接种物,对照组则加入等量的灭菌混合接种物,其上覆盖约 2cm 厚的混合土拌匀.每盆移栽 4 棵幼苗,喷水润湿.最后铺盖 0.5cm 厚的河砂[25]待番茄长出两片真叶后,采用灌根法接入菌液,接种前土壤浇水灌透,用玻璃棒在离番茄幼苗根茎约 3cm 处的土壤表面扎深度约 5cm 的小孔,加入 5mL 枯草芽孢杆菌悬浮液.培养过程中,培养箱设置为温度 23~28 , ℃ 相对湿度 60%~80%,阴雨天打开补光灯进行补光,每隔 3d 浇 50mL 盐溶液,每天浇约300mL 水,其它常规管理.
1.3 测定项目及方法
1.3.1 土壤 pH 值、含水量及电导率
土壤 pH 值测定:土壤 pH 值是土壤悬浊液氢离子活度的负对数,在 pH 值检测时,先将 pH 计校准,然后再用 pH 计测量由预处理后的土壤制取的土壤悬浊液 pH 值[26].
含水量测定:取新鲜土样放入铝盒,于分析天平上称重并准确至 0.01g.揭开盒盖,置于已预热至(105±2)℃的烘箱(DHG-9245A)中烘烤 12h.取出盖好,移入干燥器内冷却至室温(约 30min),立即称重.新鲜土样水分的测定应做 3 份平行测定[27].
电导率测定:取一份经过烘干碾磨成粉状的土样进行过筛 (0.25mm), 制 成 1:5 的 浸 提 液 , 用DPP-210 便携式电导仪测定其电导率[28].
1.3.2 土壤有机物及营养元素(N、P、K)含量
称取风干土样(过 100 目筛)至 50mL 高型烧杯中,分别加入 10.0mL 浓硫酸和 10.0mL 重铬酸钾溶液,不断摇动,停放静置 20min 后加 10.0mL 水,摇匀,静置.吸取上清液 15.0mL 于 50mL 容量瓶中,加水至刻度充分摇匀,用 1cm 光径比色杯在 590nm 波长比色[29].
称取土壤样品约 1g 于消化管中 420℃消化约1h,静置至室温,缓慢加入约 20mL 水冷却后,使用凯氏定氮法测定样品中全氮含量[30].参照夏皖豫等[31]的方法,采用碳酸氢钠浸提-钼锑抗分光光度法测定速效磷含量.另外使用火焰原子吸收光谱法测定速效钾含量[32].
1.3.3 土壤中脲酶、蔗糖酶和过氧化氢酶活性
采集番茄植株根部 5~15cm 深度的土样,挑除土样中杂物和细根,碾碎,过筛装入封口袋中.土样置于实验室内通风处自然风干,用于测定土壤酶活性.脲酶(URE)活性采用苯酚-次氯酸比色法测定[33],蔗糖酶(SUC)采用 3,5-二硝基水杨酸比色法[34]测定.过氧化氢酶(CAT)活性采用紫外分光光度法[35]测定.
1.3.4 番茄表观生长指标
实验期间在第 30d 时,取番茄植株的地上部和地下部,用清水洗净表面杂物,采用钢卷尺测量幼苗植株的株高和根长.
1.3.5 AMF 菌根侵染率及根际土壤微生物分离AMF
侵染率测定基于染色镜检法,主要分为根系透明-染色-分色 3 个过程.参考台盼蓝染色-十字交叉法[36]:称取 1~2g 左右新鲜根系,洗净后剪成长约 1cm根段,置于组织包埋盒中,随后放入装有 10% KOH溶液烧杯中,在 90℃水浴锅中浸没 10~90min,直至根系变得透明.将组织包埋盒洗净后浸入 2% HCL 溶液,常温浸泡 5~10min,再用蒸馏水洗净,取出放入装有 0.05%台盼蓝溶液的烧杯内,水浴锅 90℃恒温加热染色10~30min,取出后组织包埋盒洗净,脱色2~3d.脱色后随机挑取 30 个根段制片,每张载玻片压制 10根,每个根段观察 10 个视野,以泡囊为观测指标,用十字交叉法进行侵染率测定.将其中一条十字线与根系平行,记录观测根部位于垂直线上的泡囊数目为观测点泡囊数,若观测点无泡囊则记为无侵染.
计算公式为:菌根侵染率(%)=(观测点泡囊数目/总检测交叉点数)×100%.
稀释涂布平板法[37]计算真菌、细菌、放线菌数量.
1.4 数据处理
实验数据采用 Microsoft Excel 2010 整理试验数据,通过 SPSS 26.0 统计软件单因素方差分析(one-way ANOVA)和 Duncan 法计算平均值和标准误差,分析显著性差异(α=0.05 及 α=0.01).用 OriginPro 2022 软件作图,所有数据用平均值±标准误表示.
2 结果与分析
2.1 不同盐浓度处理番茄表观生长指标的变化
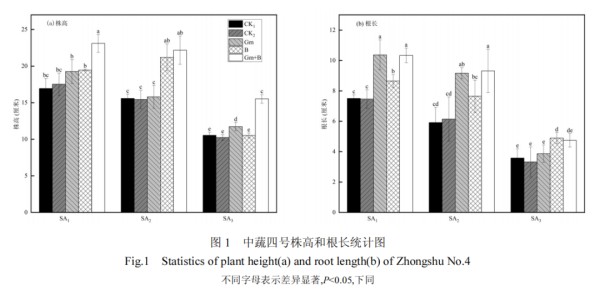
土壤中过高浓度的盐碱对番茄的株高根长有明显的抑制作用,且浓度越高,抑制作用逐步增强(图1).促生菌的单独施加(Gm、B)与协同施加(Gm+B)对番茄的生长发育均有明显促进作用.接种 AMF 的处理组根长得到明显提升,而对于株高的影响,在15mmol/L 处理时两菌作用相当,在 75mmol/L 处理下 B 组增幅较大,150mmol/L 处理时 Gm 组增幅更大.15,75和150mmol/L胁迫液处理后,最大增量分别为 13.64%(Gm)、36.03%(B)和 47.29%(Gm+B).且两种促生菌协同施加对番茄根长的增幅远高于单促生菌处理组,最大增幅较 CK1 可达 57.52%(Gm+B),较 CK2可达 58.04% (Gm+B).
2.2 不同盐浓度处理土壤物理性质的变化
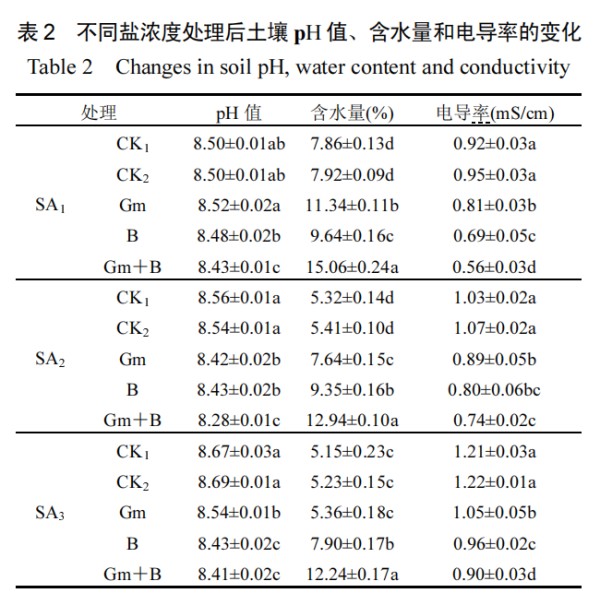
随盐胁迫浓度提升,土壤 pH 值与电导率呈上升趋势,土壤含水量显著下降(表 2).而外源施加 AMF和枯草芽孢杆菌后,Gm+B 组盐碱土 pH 值均存在不同程度的降低.其中,中度胁迫与高度胁迫下 Gm+B组较CK1分别显著下降3.27%和3.00%.中度胁迫下Gm+B 组含水量较 CK1组、CK2组、Gm 组、B 组分别上升 143.23%、139.19%、128.36%、54.94%,另一方面,施加促生菌后各处理组土壤电导率与 CK组相比有明显降低,双菌处理组(Gm+B)电导率下降幅度最大,可达 39.13%,说明在双菌与番茄的共同作用下,土壤抵御盐碱胁迫效果最好.
2.3 不同盐浓度处理土壤有机质及营养元素含量的变化
2.3.1 有机质含量的变化
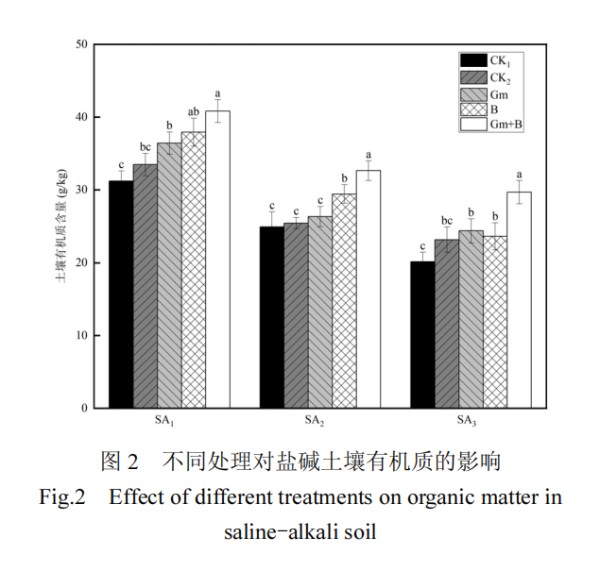
在不同盐碱胁迫条件下,CK2 与 CK1 相比,添加灭活菌剂后土壤有机质含量有所增加(图 2).在 SA3 处理下土壤有机质含量显著低于 SA1和 SA2处理,分别下降 35.39%和 19.03%,进一步分析发现,在 3 种浓度盐碱胁迫下,菌种协同施加(Gm+B)与相应浓度盐胁迫下 CK1 相比,土壤有机质含量显著增加,分别上升 30.78%、31.03%、47.15%;而同浓度盐碱胁迫下,单菌处理组(Gm、B)较 CK1增幅分别为 21.49%、18.11%、20.82%,作用效果普遍低于复合菌剂.
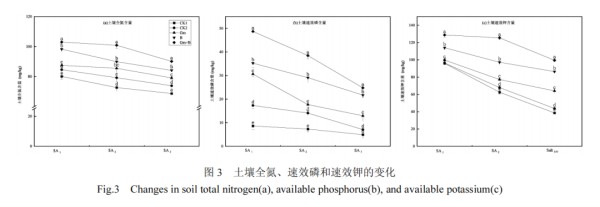
2.3.2 土壤全氮(N)、速效磷(P)和速效钾(K)含量的变化
在 SA3处理下,土壤中 N、P、K 含量较 SA1均有不同程度下降(图 3),分别为 14.23%、42.81%和59.75%.CK2在 SA2 (N)、SA1 (P)、SA3 (K)处理下营养元素含量较 CK1分别显著提升 8.99%、100.93%、13.25%.另外,添加了 AMF 和枯草芽孢杆菌后,N、P、K 含量均呈上升趋势,且分别在 SA2、SA1以及 SA3处理下达到最大提升,显著增加 38.85%、465.20%、157.75%.然而在单一菌种处理下,N、P、K 含量在添加枯草芽孢杆菌时较CK1增幅明显,分别达22.70%、308.93%以及 123.96%,说明经混合菌剂处理后土壤无机养分含量显著高于单菌接种和 CK1.因此,施加两种菌剂有助于促进土壤中 N、P、K 元素释放,提升土壤肥力,促使退化土壤环境的恢复.
2.4 不同盐浓度处理土壤酶活性的变化
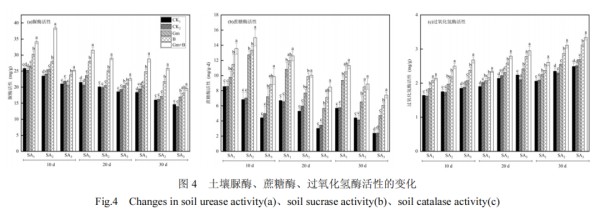
在施加促生菌后,3 种土壤酶活性显著增强,混合菌群的效果优于单一菌株(图 4).SA1 处理组在胁迫 20d 后改善效果更加,增加了 46.57%.而 SA2处理组在双菌共施后 10d 活性增加了 63.64%,在 30d 后增加了 61.25%.SA3 处理组土壤蔗糖酶和土壤过氧化氢酶活性改善效果最佳,土壤蔗糖酶在胁迫10,20,30d 时,活性提高 123.04%、179.71%、209.63%,土壤过氧化氢酶活性分别提高 45.26%、31.31%、34.11%.此外,不同浓度胁迫 20~30d 时,双菌处理组(Gm+B)的脲酶和蔗糖酶活性下降速率较 CK1 组均有所减缓,最低可降至 9.53%、10.03%;过氧化氢酶活性增长速率较 CK1 组则有所增加,最高可达10.97%.

2.5 不同盐浓度处理土壤微生物的数量变化

由表 3AMF、枯草芽孢杆菌对盐碱胁迫土壤微生物的影响可知,随着胁迫加深,土壤中细菌、真菌、放线菌的数量均呈现出随胁迫液浓度增大而减少的趋势.试验对照 CK1 和 CK2 发现土壤细菌、真菌和放线菌含量无显著差异,表明单独添加灭活菌剂和菌培养液对土壤细菌、真菌和放线菌的数目无影响.接种促生菌后,细菌和放线菌数量均显著扩大,最高可达 2.67(×103cfu/g)和 47.50(×104cfu/g),真菌数目波动变化.其中,细菌、真菌和放线菌数目在各处理下分别表现为 CK1=CK21=CK21=CK21的 1.93倍(SA2)、1.25 倍(SA2)、4.37 倍(SA3).
2.6 AMF 侵染率
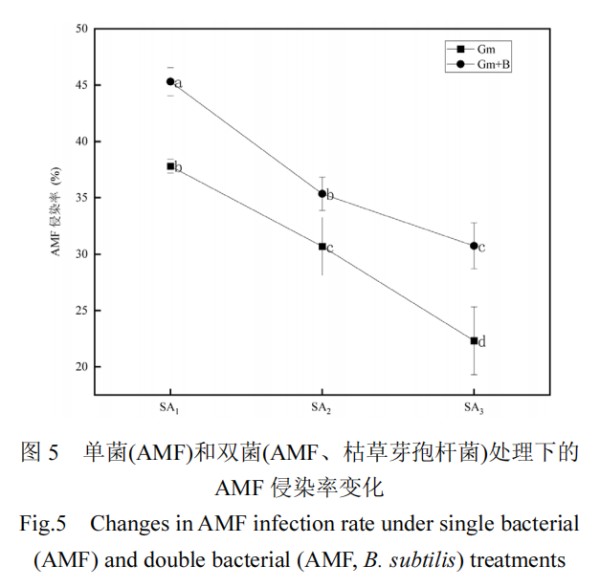
图 5 展示了在单施 AMF 和联合施用 AMF 与枯草芽孢杆菌下菌根侵染率的变化,未施加 AMF 的处理组(CK1、CK2、B)难以观测到泡囊、菌丝与丛枝等结构,测得 AMF 侵染率为 0%.AMF 菌根侵染率随盐胁迫浓度的增加而逐渐降低,表现为过高的盐离子浓度抑制了 AMF 的生长定植.在 SA1处理下,双菌处理组(Gm+B)出现最大菌根侵染率 45.31%,在 SA3处理下,双菌处理组(Gm+B)AMF 侵染率较单独施加 AMF 组(Gm)显著增加,增幅为 37.72%.
3 讨论
株高和根长直观地反映了番茄的植株生长状况.接种枯草芽孢杆菌的处理组株高变化在低浓度最为明显,该浓度下矿物金属离子随枯草芽孢杆菌分泌物的溶出率最高,部分有机质由于失去矿物质的支撑而溶出,增加盐碱土壤的有机成分,降低盐碱度[38].同时根系增长主要受生长素调控,根长的增长与盐碱胁迫浓度无直接关系,在各浓度处理组中增幅相差不大.AMF-枯草芽孢杆菌联合施用能显著提高作物对土壤养分以及微量元素的吸收利用,有效加强植株的抗盐碱胁迫能力,对盐碱胁迫下的番茄植株有明显的促生作用.
外源促生菌的施加能够使土壤含水量提高,且Gm+B 组增幅最为显著,其能增加土壤水稳性大团聚体数量,提高土壤保水性,这与杨世伟等[15]的结论一致.中度胁迫下 Gm+B 组含水量为 12.94%,高于其他处理组,主要是因为 AMF 对中度胁迫下的长距离端受体渗透调节物质的积累发挥极大的促进作用 [16].植物根与根际土壤间不断进行物质和能量交换.添加两种菌剂后,全氮、速效磷和速效钾含量均增加,可能是 AMF 与植物根系共生形成的丛枝菌根结构扩大了植物根系的吸收面积,促进了根际土壤中的物质交换;而枯草芽孢杆菌则通过分解有机质释放营养元素或合成植物生长激素促进了植物根系的生长与发育[39].此外在不同盐碱胁迫条件下,双菌种共同分解和降解有机质的能力和速率各有差异,从而影响了土壤中营养元素的释放.作为土壤质量与健康的关键指标和养分载体,土壤有机质可调节土壤矿质元素的转化,综合反应土壤质量与土壤功能[40].在盐碱胁迫条件下,土壤有机质受到显著影响,其含量与胁迫浓度呈负相关关系,这与李少朋等 [41]实验结果趋势相符.高浓度处理后的土壤有机质显著低于其他,这提示在高浓度盐碱环境下盐分通过增加土壤电导率,促进有机质的矿化作用并加速有机质的流失.施加促生菌后,与 CK1 相比土壤有机质含量分别提升 30.78%、31.03%、47.15%,而单菌处理组较 CK1 的最大提升幅度分别为 SA1+B 的21.49%、SA2+B 的 18.11%、SA3+Gm 的 20.82%,作用效果普遍低于复合菌剂.AMF 和枯草芽孢杆菌在土壤中分泌的有机物、酸性物质等可能将矿物表面的金属离子溶出,同时带出部分有机质,使得盐碱土壤的有机成分增加,电导率下降,这与逄焕成等[42]的实验结论相符.综上,施加AMF和枯草芽孢杆菌均能够降低盐碱土壤 pH 值和电导率,增加土壤含水量,且两者协同处理下效果最佳,能够更好地促进土壤脱盐、缓解盐碱土板结状况、优化土壤结构、促进作物对土壤中营养物质的转化吸收.
土壤酶活性与土壤氮磷养分的转移与吸收有关[43].随着胁迫浓度升高和胁迫时间延长,脲酶和蔗糖酶活性普遍下降,而过氧化氢酶则呈上升趋势,这与颜路明等[44]实验趋势相符.高盐离子浓度抑制了植物与土壤微生物的生理活性,降低了其分泌脲酶与蔗糖酶的能力以及土壤中原有酶的活性,并引起氧化胁迫,促使受试植物与土壤微生物合成过氧化氢酶以维持自身氧化平衡.实验中,3 种土壤酶活性均在 Gm+B 组处理下较 CK1 组达最大增幅,土壤蔗糖酶和土壤过氧化氢酶均于 SA3处理条件下达最大增幅.土壤脲酶在盐胁迫 10 和 30d 时,均在 SA2 处理下达到最大提升,施加生防菌后土壤脲酶在不同时间段,其酶活性增幅达最值的对应盐浓度不同,表明土壤产生脲酶的微生物对于生防菌的适应力随时间推移呈现一定的变化趋势.由此可见,AMF 与枯草芽孢杆菌对不同土壤酶活性的影响存在显著差异,且其联合施用能产生协同效应,有效缓解土壤中盐离子对植物和土壤微生物的胁迫,促进脲酶与蔗糖酶的分泌,同时刺激过氧化氢酶的生成,显著提升土壤酶活性指数,进而促进土壤养分循环,改善土壤微生态环境.
土壤微生物数目与丰富度在一定程度上能反映出土壤的质量状况与土壤中物质代谢的快慢程度[45].经探究可知,盐碱土壤中过高的盐分会扰乱微生物的生理代谢过程,从而抑制土壤细菌、放线菌的生长繁殖,而真菌因其较强的抗逆性,降幅较小.外施两种促生菌后,盐碱胁迫对微生物的抑制作用得到有效缓解,其数量明显扩大,这与 Zhang 等[46]实验结果相符.细菌、真菌和放线菌数目在各处理下分别表现为为 CK1=CK2CK1=CK2CK1=CK2且均在Gm+B处理下显著增加.此外,实验发现 3 种盐浓度胁迫下,B组真菌数量均低于 CK1 和 CK2,表明枯草芽孢杆菌可降低真菌的群落数量,论证了赵志祥等[47]研究结果的可信度.从 3 种土壤微生物变化趋势可看出,AMF、枯草芽孢杆菌都可促进土壤中细菌和放线菌繁殖,且真菌生长受枯草芽孢杆菌抑制,但两菌接种后,土壤真菌数目显著高于其余各处理组,表明联合施加两种菌剂能产生一定的协同效应,有效改良盐碱土微生物群落数目和结构,使得盐碱土壤微生态系统更为稳定.AMF 能分泌多种酶类、有机酸等,改变根系土壤生态环境,并能与多种植物形成菌根共生体[48].研究表明,各浓度胁迫下Gm+B组的AMF菌根侵染率均高于 Gm 组,最大菌根侵染率可达45.31%,较 Gm 组显著增加,增幅为 37.72%,可见枯草芽孢杆菌的存在能够促进 AMF 对番茄根系的侵染,提高其定植率,论证了姜海燕[49]试验结果的可信度.结合上述相关指标可知,AMF 与番茄根系形成的菌根复合体能够通过促使植物根系发育,扩大受试植物根系的吸收面积来提高植株抗逆性和存活率,使得植物根系分泌更多生物酶和有机酸,中和土壤中过高的盐碱.植物发达的根系也能促使土壤脱盐,改善土壤结构,并为枯草芽孢杆菌提供了合适生存环境,提高其种群数量.与此同时,外施枯草芽孢杆菌能够分泌多种胞外酶和有机酸来降低土壤 pH 值,减轻盐碱胁迫对 AMF 菌丝的损害,因此两者协同施加可有效改良盐碱土的理化性质,实现盐碱土的修复.
4 结论
4.1 土壤中过高的盐离子会显著抑制番茄的生长,降低AMF定植率,且随着盐浓度的增加,抑制作用逐步增强.施加两种生防菌后,番茄的株高、根长增加,且两菌协同施加后,番茄株高、根长增幅进一步上升,AMF 侵染率升高,分别为 SA3+Gm+B (47.20%)、SA2+Gm+B (57.52%)和 SA3+Gm+B (37.72%).
4.2 联合施用两种微生物能降低盐碱土壤的pH值和电导率,并提高土壤含水量,有助于缓解盐碱土板结状况、优化土壤结构.
4.3 盐碱胁迫对土壤营养物质含量影响较大,添加AMF 和枯草芽孢杆菌后,与 CK1相比全氮(N)、速效磷(P)和速效钾(K)含量最高可达 38.85%、465.20%、157.75%,有机质含量达 47.15%,显著高于单菌接种(Gm、B)和不施加菌处理(CK1、CK2).
4.4 两种微生物的联合作用降低了土壤中脲酶和蔗糖酶活性,提高过氧化氢酶活性,脲酶和蔗糖酶活性最低可降至 CK1的 9.53%、10.03%;过氧化氢酶活性增长速率较 CK1组则有所增加,最高可达 10.97%.
4.5 盐碱胁迫会破坏土壤中微生物群落结构并抑制其增殖,且胁迫程度越高,抑制作用越明显.外源施加生防菌能够增加土壤中细菌、真菌和放线菌的数目,土壤中细菌、真菌、放线菌数目均得到提升,最大依次为 CK1的 1.93 倍(SA2+Gm+B)、1.25 倍(SA2+Gm+B)、4.37 倍(SA3+Gm+B),有效改良了盐碱土微生物群落的结构.
参考文献









叶玢妤,俞 跃,何沛益,等.丛枝菌根真菌-枯草芽孢杆菌组合体系对盐碱土壤微生态的修复作用 [J]. 中国环境科学, 2025,45(1):440-449.
Ye B Y, Yu Y, He P Y, et al. Remediation of saline-alkali soil microecology by a combined system of mycorrhizal fungus-Bacillus subtilis [J]. China
Environmental Science, 2025,45(1):440-449.
(生态修复网)(转自:生态修复网)
新浪财经ESG评级中心简介
新浪财经ESG评级中心是业内首个中文ESG专业资讯和评级聚合平台,致力于宣传和推广可持续发展,责任投资,与ESG(环境、社会和公司治理)价值理念,传播ESG的企业实践行动和榜样力量,推动中国ESG事业的发展,促进中国ESG评估标准的建立和企业评级的提升。
依托ESG评级中心,新浪财经发布多只ESG创新指数,为关注企业ESG表现的投资者提供更多选择。同时,新浪财经成立中国ESG领导者组织论坛,携手中国ESG领导企业和合作伙伴,通过环境、社会和公司治理理念,推动建立适合中国时代特征的ESG评价标准体系,促进中国资产管理行业ESG投资发展。

海量资讯、精准解读,尽在新浪财经APP
网址:【专家视角】 丛枝菌根真菌-枯草芽孢杆菌组合体系对盐碱土壤微生态的修复作用 https://www.yuejiaxmz.com/news/view/813951
相关内容
一种以芽孢杆菌为主菌群的污水处理设备的制作方法细胞实验室空间环境消毒“芽孢”如何消毒灭菌?
iMeta|中科院地球环境研究所王云强组解析了草地土壤微生物生活史策略
物业环境绿化日常管理课件.ppt
农业部发布绿色食品生产允许使用的农药和其他植保产品清单
墙体霉菌
消毒与灭菌
浴室里的霉菌: 如何去除和清除真菌的类型
(7分)一到春季,保存不当的食品和衣物表面很容易发霉。霉菌的生活受
家中这4处很容易藏有霉菌,一定要知道

