标准与规范
笔记的标准化和规范化 #生活技巧# #学习技巧# #笔记整理策略#

引用本文:中华医学会肠外肠内营养学分会. 中国成人患者肠外肠内营养临床应用指南(2023版) [J] . 中华医学杂志, 2023, 103(13) : 946-974. DOI: 10.3760/cma.j.cn112137-20221116-02407.
通信作者:杨桦,重庆市人民医院普外科,重庆 400037,Email:hwbyang@126.com;朱明炜,北普外科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730,Email:zhumw2013@163.com;陈伟,中国医学科学院 北京协和医学院 北京协和医院临床营养科,北京 100730,Email:txchenwei@sina.com;王新颖,东部战区总医院普外科,南京 210002,Email:wangxinying@nju.edu.cn.
摘要
营养不良是指由于摄入不足或利用障碍引起能量或营养素缺乏的状态,是导致不良临床结局的主要因素。为进一步规范营养支持治疗流程,由中华医学会肠外肠内营养学分会(CSPEN)组织国内近百位相关领域的专家,基于现有的循证医学证据,围绕以下主题进行阐述:营养筛查及评估;营养不良的诊断及监测;营养支持治疗的诊疗流程、供能目标及卫生经济学效益;肠内营养(EN)和肠外营养(PN)的适应证、启动时机、输注方式及配方的选择;营养支持治疗耐受性的监测、并发症的预防及管理等,最终提出37个问题、60条推荐意见,旨在为肠外肠内营养的临床规范应用提供参考。
为进一步规范营养支持治疗的流程,以指导临床和科研工作,由中华医学会肠外肠内营养学分会(CSPEN)牵头,邀请国内近百位包涵外科、内科、重症医学科、临床营养、护理、循证医学和统计学等相关领域的专家,进行《中国成人患者肠外肠内营养临床应用指南(2023版)》的修订工作。本着科学化、规范化、透明化和制度化的原则,指南修订工作遵循国际指南编写标准和中华医学会《中国制订/修订临床诊疗指南的指导原则》(2022版)[1]中的临床诊疗指南制订/修订的核心方法与基本流程,并完成指南的注册申请(注册网址:http://www.guidelines-registry.org/)。本指南的制定将成为临床医生进行营养治疗的重要参考,可更好地规范临床营养治疗,使更多患者获益。
一、指南制定的方法及流程
CSPEN牵头并组建《中国成人患者肠外肠内营养临床应用指南(2023版)》编写团队,坚持以研究对象、干预措施、对照措施、结局、研究类型(PICOS)为导向、证据级别与推荐并重和服务于临床的宗旨,设立文献支持小组并确定主要的检索策略,包括以下内容:(1)2002年7月至2022年6月发表的文献(少数经典文献除外)。(2)关键词主要包括:nutrition screening、nutrition assessment、gastrointestinal function assessment、nutrition diagnosis、nutritional support therapy、enteral nutrition、early enteral nutrition、oral nutritional supplement、enteral nutrition formulae、parenteral nutrition、supplementary parenteral nutrition、lipid emulsion、ω-3 fatty acid和glutamine;营养筛查、营养评估、胃肠功能评估、营养诊断、营养支持治疗、肠内营养、早期肠内营养、口服营养补充、肠内营养配方、肠外营养、补充性肠外营养、脂肪乳(剂)、ω-3脂肪酸和谷氨酰胺。(3)二级数据库为Guideline Clearing House、Cochrane Library和Sum Search;一级数据库为PubMed、EMBASE、Web of Science、中国生物医学文献数据库、中国知网和万方医学等。
由于牛津循证医学中心(OCEBM)的分级系统简单地将证据级别与推荐强度直接挂钩,证据和推荐意见的分级缺乏客观可操作的标准,易产生较强的主观性[2]。近年来越来越多的国际性学术组织采用评估、发展和评价建议的分级(GRADE)[3]系统更新其指南,如美国肠外肠内营养学会(ASPEN)和欧洲肠外肠内营养学会(ESPEN)于2016—2022年推出的各种治疗指南即采用GRADE系统。经集体讨论,在本指南的证据和推荐意见采用GRADE分级系统。
本指南按“问题、推荐意见(证据级别、推荐级别)、证据简述”的基本框架进行阐述,包括营养筛查与评估、肠内营养(EN)和肠外营养(PN)等内容。根据临床问题检索并合成证据,必要时对文献进行系统评价,最后形成推荐意见;再总结关键性临床问题的证据,在充分考虑卫生经济学效应后作出结论。当一项干预措施的益处超过其风险且经济上可负担时,推荐意见为“强推荐”;当获益减弱或风险增加时,推荐意见降级为“弱推荐”;当风险大于益处或获益较少而经济负担较大时,推荐意见为“强烈不推荐”或“不推荐”;当证据不足或高质量证据较少时,可给出专家意见,但亦需考虑获益与风险的程度及其经济负担。对于有分歧的推荐意见,采用“德尔菲法则”,编写支持小组与各专业领域的专家讨论后达成“循证共识”进而解决分歧。指南定稿后,CSPEN组织300位全体委员及部分特邀的相关领域专家采用线上投票的方式,投票专家对每一条推荐意见及其强度在线上平台中勾选“强烈同意”“同意”“不同意”“强烈不同意”四个选项中的一项,获得“强烈同意”和“同意”的票数达到或超过投票专家总数的50%,则在领域专家中达成共识,可予以公布。经统计有277位专家参加本次投票,领域包括外科39.7%(110位)、重症18.1%(50位)、内科17.3%(48位)、临床营养10.5%(29位)、临床药学9.4%(26位)、护理3.6%(10位)和其他专业1.4%(急诊科和儿科各2位),投票结果纳入指南推荐意见中。所有参与人员均声明:未接受任何利益相关公司的赞助或股票;未持有任何涉及本指南领域的专利。
二、指南提出的问题及推荐意见
问题1:哪些患者需要进行营养筛查和评估?
推荐意见1:住院患者均应进行营养筛查;对于存在营养风险或营养不良风险的患者,应进行营养评估。门诊有明显摄入不足和体重下降等情况者,也应进行营养筛查和评估(证据B,强推荐,100.0%)。
营养不良是指由于摄入不足或利用障碍引起能量或营养素缺乏的状态,进而导致人体组分改变,生理功能和精神状态下降,有可能导致不良临床结局[4]。住院患者常发生营养不良,近年来国内多中心调查研究显示,住院患者入院时营养不良发生率为14.67%~31.02%,其发生与患者年龄、基础疾病和手术因素等有关;营养不良也是导致不良临床结局的主要因素,包括住院时间延长、并发症发生率和死亡率增加等[5-6]。通过对近年席卷全球的新型冠状病毒感染的相关研究进行系统评价及荟萃分析显示,新型冠状病毒感染住院患者营养不良发生率达49.11%,合并营养不良的新型冠状病毒感染患者的死亡率是营养良好患者的10倍[7]。多项研究证实对存在营养风险的患者进行营养支持治疗可改善其预后,如减少并发症、缩短住院时间及减少医疗费用等[8-10]。首次营养筛查应当在患者入院后24 h内与问诊、体格检查等同时进行。经筛查存在营养风险的应及时进行营养评估。营养筛查和评估应由有相关执业资质并经过相关培训的医务人员完成,并及时将结果规范记录在病案首页上;经筛查暂无营养风险者,若住院时间较长,建议1周后再次筛查。
对于门诊患者,若伴有严重疾病或存在明显摄入不足或体重下降者,也应进行营养筛查和评估[11-13]。尽管已有多种营养筛查工具应用于临床和医疗机构,但其各有所长,其筛查的信度和效度受人种、生活习惯、身体组成、年龄及合并疾病等多种因素影响,但尚无适合所有患者的营养筛查工具。
问题2:何种营养筛查方法适用于成人患者?
推荐意见2:营养风险筛查2002(NRS 2002)可用于成人患者;住院、门诊、社区居家及医养机构的成人群体可用微型营养评定法简表(MNA-SF)及营养不良通用筛查工具(MUST)等进行营养筛查(证据A,弱推荐,99.3%)。
推荐意见3:重症患者的营养筛查可使用NRS 2002和(或)重症患者营养评估工具NUTRIC评分(证据C,弱推荐,98.2%)。
2018年ESPEN、ASPEN、亚洲肠外肠内营养学会(PENSA)及拉丁美洲肠外肠内营养学会(FELANPE)等共同制订并发布了营养不良诊断标准(GLIM)[14],将营养不良的诊断过程明确分为“营养筛查”和“诊断评定”两个步骤;并将NRS 2002、MNA-SF和MUST等纳入推荐的营养筛查方法中[14]。
NRS 2002有循证医学基础,多项研究结果显示存在营养风险的患者行营养支持治疗更有效(能够改善临床结局);而对于无营养风险的患者,其疗效不明显[15]。自2005年起CSPEN应用NRS 2002在中国组织的多项前瞻性研究均证实给予存在营养风险(NRS 2002≥3分)的患者营养支持治疗,可改善其临床结局指标[8,16-17]。因其识别营养风险的敏感性和特异性均较高,国内外多个营养指南或共识均推荐NRS 2002做为住院患者首选的营养筛查工具[18-19]。
MNA-SF用于识别营养不良或已可能发生营养不良的人群[20]。基于大样本人群研究的系统评价显示,该筛查工具对于识别营养不良具有良好的价值,尤以老年人群为著,当体重及体质指数(BMI)无法测量时,可用小腿围替代[21]。2011年ASPEN把MNA-SF纳入成人患者营养筛查的推荐工具[22]。CSPEN的老年营养指南建议将MNA-SF用于住院、社区居家及养老机构的老年患者,为开展规范化营养支持治疗提供依据[23]。
MUST是英国肠外肠内营养学会(BAPEN)营养不良咨询组制订的,应用范围包括医院病房、门诊、社区及其他照护机构的成人患者[24]。2017年ESPEN在营养不良术语的定义指南中,建议将MUST和NRS 2002同用于成人患者的营养风险筛查中[25]。
NRS 2002、NUTRIC评分及改良NUTRIC评分(mNUTRIC)均可用于重症患者。一项包括384例重症患者营养筛查的前瞻性研究发现,存在营养风险的占54.4%(NRS 2002)和48.4%(mNUTRIC评分)。若以≥5分为严重营养风险标准,院内死亡风险增加两倍;mNUTRIC和NRS 2002预测死亡率的受试者工作特征(ROC)曲线下面积分别为0.693和0.645,可见mNUTRIC可较好地预测死亡风险[26]。近年伊朗一项研究也得出相同结论:mNUTRIC评分可用于识别从营养支持治疗中获益的重症患者[27]。
问题3:营养不良如何诊断?
推荐意见4:对于存在营养风险或营养不良风险的患者应行营养不良的诊断;全球营养领导层倡议的GLIM适合于中国患者,可用于诊断营养不良和区分重度营养不良(证据B,强推荐,99.6%)。
既往“营养不良”和“重度营养不良”的诊断标准中,无论是物理测量指标(BMI、上臂围等),或是实验室指标(白蛋白、前白蛋白等),还是综合营养评估工具[主观全面营养评定(SGA)、微型营养评估(MNA)等],均有一定的片面性,未能得到本领域多数学者的一致认同。
GLIM包括三个步骤:第一步使用营养不良或营养风险筛查工具进行营养学筛查;第二步对存在营养风险的患者,根据3项表现型指标(非自主的体重减轻、低BMI和肌肉量减少)和2项病因型指标(食物摄入或吸收减少、疾病或炎症)进行营养不良的诊断,当满足至少1项表现型指标和1项病因型指标时,认为存在营养不良;第三步根据表现型指标评定营养不良的严重程度,分为中度和重度营养不良。
一项多中心的回顾性研究以SGA为标准,认为GLIM的灵敏度和特异度为中等程度,且GLIM对重度营养不良的诊断价值更大[28]。Kakavas等[29]一项前瞻性研究显示,GLIM诊断的中、重度营养不良是腹部大手术的肿瘤患者术后90 d全因死亡率的独立预测因素。Balci等[30]研究指出,急症患者中GLIM诊断的营养不良患者5年远期死亡风险亦高于SGA和NRS 2002,同时其预测5年内死亡结局的灵敏度为59.49%,特异度为76.32%,均高于SGA和NRS 2002。此外,GLIM还可预测营养不良相关并发症的发生风险,亦可预测肌少症、衰弱等的临床结局。Haines等[31]前瞻性研究纳入美国国家外科手术质量改进计划(NSQIP)数据库中31 029例接受急诊胃肠手术(EGS)患者的数据,采用修订GLIM(mGLIM)进行营养不良的诊断,结果显示1.7%(n=517)的患者符合营养不良诊断的必要条件;控制协变量、多变量线性分析和逻辑回归分析表明,根据mGLIM标准诊断为营养不良的结肠和小肠手术患者术后死亡率均显著增加,术后并发症增多,其中结肠手术患者住院时间更长,表明mGLIM与EGS的不良临床结果相关。Song等[32]对918例接受结、直肠癌根治术的患者进行GLIM诊断。结果显示23.6%的患者被诊断为营养不良且其与术后总并发症相关,营养不良是总生存率和无病生存率的独立危险因素。Tan等[33]前瞻性研究得出GLIM标准下定义的营养不良还可用于预测术前营养状况、功能状态、癌症相关症状和生活质量等。国内多项研究认为,GLIM标准下定义的营养不良适用于中国患者[34-35]。
GLIM出现时间尚短,其准确性需更多高质量研究在不同环境中包括国人进行验证和应用,并对不同指标的定义、切点值的确定及个性化的生存预测工具等的构建进行探索。但以上情况并不妨碍GLIM标准成为目前全球业界人士高度认同的诊断营养不良的工具,在国内已有研究的基础上,成为确定营养不良和区分重度营养不良的重要方法。
问题4:营养评估包含哪些临床项目?
推荐意见5:营养评估应包括膳食调查、体格测量、实验室检查(含炎症指标及代谢指标)、人体成分分析(含肌肉量及肌力)、体能测试和营养综合评估量表等多层面指标,且随疾病治疗过程可多次评估(证据C,弱推荐,98.9%)。
营养评估的目的是确定营养不良的类型及严重程度。近期发表的一项针对临床实践指南(CPGs)中营养评定标准或工具的概况性述评指出,18篇指南中推荐的营养评估内容具有异质性,其中16篇至少含有一项人体成分参数(如肌肉量或皮下脂肪丢失),15篇含有膳食史调查,15篇含有临床病史(如体重丢失),10篇含有人体学测量(如低BMI),11篇含有生化指标(如白蛋白、C-反应蛋白),8篇含有体格检查(如液体潴留/水肿、肌肉减少症和皮下脂肪丢失等),8篇含有功能测试(如握力测量),1篇含有代谢状态。其中9篇提及营养评估综合量表,最常用的是SGA量表[36]。因而,完整的营养评估应包括膳食调查、体格测量、体格检查、实验室指标(含炎症指标及代谢指标)、人体成分分析(含肌肉量及肌力)和体能测试等多方面,可根据临床可及性、设备要求和患者情况等进行选用或组合使用,为制定营养计划提供更为精准的指导。
问题5:营养评估中有哪些方法用于评估重症患者胃肠道功能?
推荐意见6:重症患者可应用急性胃肠损伤(AGI)评估量表评估胃肠道功能,并可动态评估;AGI超声(AGIUS)检查评分也可评估胃肠道功能损伤情况(证据C,弱推荐,97.8%)。
重症患者中胃肠功能障碍发生率高,常出现胃肠道症状,较多患者在1 d内出现至少1种胃肠道症状[37]。越来越多的证据表明,胃肠道功能状况是影响EN能否有效实施的关键因素,其不仅影响EN的实施,且与患者预后相关[38]。AGI是指危重患者因病情急危而引起的胃肠道功能紊乱[38]。AGI根据临床表现分为4级,分级等级越高,患者预后越差;分级等级越低,其EN的目标量越容易实现。AGI等级影响能量的摄入量,是住院患者28 d内死亡率的危险因素之一[39]。此外,重症患者应该坚持动态AGIUS评估,有研究发现随住院时间的延长,重症监护病房(ICU)住院患者AGI评估Ⅰ~Ⅱ级比例在下降,而Ⅲ~Ⅳ级比例在增加[40]。由于AGI分级较为主观,也可使用床旁超声评估重症患者胃肠功能损伤情况并预测喂养耐受情况,如AGIUS检查评分。研究显示胃窦回声密度增加与AGI的严重程度有关,通过鼻胃管开始EN后胃窦回声密度较高的患者更易发生喂养不耐受[41]。
问题6:重度营养不良患者应如何进行营养监测?
推荐意见7:对于非自主体重显著丢失、极低营养摄入状态等重度营养不良患者,营养支持治疗前应常规监测肝、肾功能及血糖、血脂和电解质等代谢指标。特别是存在再喂养综合征(RS)高危风险者,规范的预防措施可减少并发症的发生(证据C,强推荐,98.6%)。
RS是机体经过长期饥饿或存在营养不良,重新摄入营养物质后出现以低磷血症为特征的电解质代谢及体液紊乱及由此产生的一系列症状,本质上反映了机体代谢由分解到合成的变化过程[42]。RS的高危因素包括:主要标准为BMI<16 kg/m2;3~6个月内体重减轻量>原体重的15%;很少或无营养摄入>10 d;再喂养之前即出现了低磷、低钾及低镁血症;次要标准为BMI<18.5 kg/m2;3~6个月内体重减轻量>原体重的10%;很少或无营养摄入>5 d;既往有嗜酒或药物成瘾史。患者符合一项主要标准或两项次要标准即可判定为高危患者。识别高危人群并遵循循序渐进的营养干预原则,及加强监测是RS的主要预防方法。目前认为血磷、血钾和(或)血镁的水平降低10%~20%为轻度RS;降低20%~30%为中度RS;降低程度>30%和(或)由于这些电解质和(或)硫胺素缺乏导致器官功能障碍者为重度RS[43]。营养支持治疗前后,应常规定期监测肝、肾功能及血糖、血脂和电解质等代谢指标的变化,以预防代谢性并发症和RS的发生。
重症患者的营养治疗过程中血糖波动大,血糖监测和胰岛素治疗是必要手段,可通过微量泵控制胰岛素的剂量。近年来多项研究认为外科患者术后可直接将胰岛素加入PN液中,并将任一时间的血糖控制目标定为8~10 mmol/L[44-45]。脂肪乳输入速度过快或输入总量过多时,可发生高脂血症。当患者出现发热、血小板减少、溶血或肝、脾肿大等症状时,要除外脂肪超载综合征,并停止输注脂肪乳剂。脂肪乳剂应用时间较长、剂量较大或脂肪廓清能力受损的患者,应定期做血清浊度试验或血脂测定,以了解机体对脂肪的利用和廓清能力,一般认为血中甘油三酯超过4.0 mmol/L时,脂肪量宜降低甚至暂停。血磷、血钾和血镁等电解质中任一种减少都可能是代谢严重缺陷的信号,需定期监测或干预,如不预防或纠正,将会发展为器官衰竭或风险加重[43]。维生素和微量元素缺乏症可能需更长时间才能表现出临床症状和体征,长时间PN还可发生代谢性骨病,定期规律随访是必要的。硫胺素缺乏可导致神经系统功能异常,包括精神错乱、脑病、眼动异常(主要为水平眼麻痹)和体温过低,甚至昏迷等。缺乏硫胺素的患者易发生高乳酸血症,导致充血性心力衰竭[43]。
问题7:如何设定成人患者营养支持治疗的能量和蛋白质目标?
推荐意见8:通过间接测热法可实际测量机体静息能量消耗值以设定能量目标,也可参考25~30 kcal·kg-1·d-1(1 kcal=4.18 kJ)进行经验估算(证据B,强推荐,98.6%)。
推荐意见9:营养支持治疗中蛋白质供给应根据临床实际情况进行判断,一般应达到1.2~1.5 g·kg-1·d-1(证据B,强推荐,97.5%)。
人体对营养物质的需要量呈现个体化,应根据疾病的不同状况、不同阶段及机体重要器官功能情况而定。Sion-Sarid等[46]认为,通过定期测定患者的间接能量代谢,有助于制订动态且个体化的营养目标。Zusman等[47]对ICU患者的研究表明间接测热法优于通过预测方程得到的静息能量消耗。精准测定静息能量消耗是精准营养支持治疗的基础,近年来国内、外多个营养支持治疗指南均推荐使用间接测热法测量机体静息能量消耗值[19,23,48]。但间接测热法需要的设备是非医疗机构的常规设备,因而可能无法适用于临床。若患者的总能量无法测定,采用25~30 kcal·kg-1·d-1估算的方法更为简单实用,并与实测数值较为接近,对于严重创伤或重症患者,第1周提供目标能量的70%更适合创伤应激的代谢特点[19,23,48]。
创伤应激状态下皮质醇和肾上腺素等分泌增加,胰岛素分泌减少,体内肌肉蛋白分解增加为糖异生提供原料。与此同时,尿氮的排出量也相应增加,机体处于明显的负氮平衡状态。在营养干预中增加蛋白质的补充量,有益于改善营养状态并使患者受益。Weijs等[49]的报道指出相较于单纯能量达标,能量和蛋白质均达标可明显降低患者的死亡风险。需机械通气的非脓毒症患者在无过度喂养时,蛋白质摄入量越高,其病死率越低。近年来越来越多的研究显示,蛋白质的供给量是肠外肠内营养支持治疗的疗效及临床结局的独立预测因素。Ferrie等[50]分别给予重症患者氨基酸含量为0.8 g·kg-1·d-1(低氨基酸含量组)及1.2 g·kg-1·d-1(高氨基酸含量组)的PN溶液,结果高氨基酸含量组患者的握力、疲劳及前臂肌肉厚度改善程度均优于低氨基酸组。Nakamura等[51]对比高蛋白(目标能量20 kcal·kg-1·d-1,蛋白质1.8 g·kg-1·d-1)和中等量蛋白(目标能量20 kcal·kg-1·d-1,蛋白质0.9 g·kg-1·d-1)的营养方案对重症患者肌肉减少程度影响的随机对照试验(RCT)中,结果显示高蛋白组的肌肉丢失程度较低,且持续性炎症、免疫抑制和分解代谢综合征的发生率也降低。O′Keefe等[52]的回顾性研究显示EN中加入2 g·kg-1·d-1的蛋白质对于外科大手术和创伤患者是安全的。最新的ASPEN指南推荐重症患者蛋白摄入量1.2~2.0 g·kg-1·d-1[53];ESPEN指南推荐重症患者蛋白摄入量应≥1.3 g·kg-1·d-1,肥胖患者应调整体重后进行估算[54]。
问题8:重症患者营养支持治疗的能量和蛋白质目标值以多少为宜?
推荐意见10:高营养风险或重度营养不良的重症患者,营养治疗初始时进行适度喂养(目标量的50%~70%)可使临床获益;并建议在预防RS的同时,于48~72 h内达到预估目标能量和蛋白质的80%(证据A,弱推荐,97.1%)。
充足的能量和蛋白质是影响营养疗效和临床结局的重要因素,能量及蛋白质摄入不足会造成机体组织消耗,影响器官的结构和功能,进而影响预后。早期适度喂养被证实对重症患者更有益。一项纳入了4项RCT研究的荟萃分析比较了早期低能量喂养(<目标量的60%~70%)和完全喂养(目标量的90%~100%)对仅接受EN治疗的急性重症患者的总体死亡率的影响,两者间的差异无统计意义(P=0.61),但适度喂养亚组(≥目标量的33.3%)的总体死亡率低于完全喂养组(P=0.05)[55]。同年发表的另外一项纳入了8项RCT研究、共计1 895例研究对象的荟萃分析也得出类似的发现[56]。虽然低能量喂养组和高能量喂养组之间的死亡率、感染发生率及胃肠道不耐受风险间的差异无统计意义,但进一步做亚组分析发现将低能量喂养组分为3组(<目标量的33.3%;目标量的33.3%~66.6%;>目标量的66.6%),并与高能量喂养相比,仅在适度喂养(目标量的33.3%~66.6%)组观察到患者的死亡率低于高能量喂养组(P=0.01)[56]。
Tsai等[57]研究发现,入院后接受<60%目标能量的患者,其死亡风险是接受≥60%目标能量患者的2.43倍。在一项前瞻性多中心队列研究中,Jie等[16]表明,对于高营养风险(NRS 2002评分≥5分)的手术患者来说,与未接受充分治疗的患者相比,接受充分术前营养支持治疗(连续7 d能量摄入≥10 kcal·kg-1·d-1)的患者其总体并发症的发生率显著降低,术后住院时间显著缩短。Heyland等[58]回顾性研究亦证实,随EN能量及蛋白质供给量的增多,机械通气重症患者发生感染的风险降低,且两者存在剂量-效应关系。
问题9:规范化营养诊疗流程包括哪些内容?
推荐意见11:住院患者规范化营养诊疗流程应包含筛查、评估、诊断、干预及监测等关键步骤,并形成连续的诊疗模式(证据B,强推荐,99.6%)。
研究证实按照营养诊疗标准流程实施营养诊疗方案,能满足患者蛋白质和能量的供给并改善临床结局[59]。因此规范化营养诊疗流程应包括“筛查、评估、诊断、干预及监测”等关键步骤,并应形成连续的诊疗模式(图1)。医疗机构应加强院级营养筛查、评估及诊断管理,并列入医院医疗管理内容以进行监管和制定相应的工作制度和流程;应当按照有关规定规范书写及保存病历,如将营养风险及营养不良及时记录在病案首页上,并加强相关诊疗信息的统计分析[4,60]。
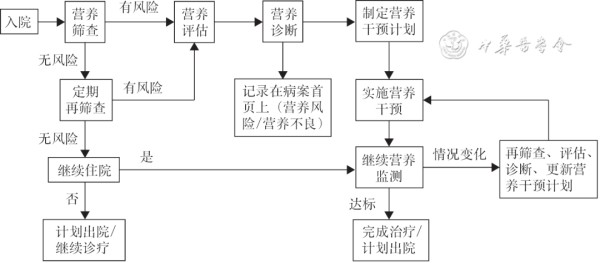
图1 住院患者规范化营养诊疗流程图
问题10:建立营养支持治疗团队有何意义?
推荐意见12:营养支持治疗团队的负责人为临床专家,建立包括临床医师、营养(医)师、康复医师、临床药师及专科护师等在内的多学科团队,提供规范的筛查、评估、诊断、干预及监测等营养诊疗工作(证据D,弱推荐,99.3%)。
营养支持治疗团队的组成中,临床专家发挥协助组建和管理的作用,营养(医)师、临床药师、物理康复医师和专科护师作为团队的主要成员,外科、口腔科、神经科和心理医学科等临床专科医师为管理团队提供技术保障。营养支持治疗团队的主要工作目标是为患者提供合理的营养支持治疗,包括:(1)识别是否存在营养不良或营养风险;(2)制订合理的营养支持治疗方案;(3)提供安全、合理和有效的营养支持治疗;(4)监测及评价营养支持治疗的效果[61]。已有部分研究证实营养支持治疗团队的存在能提高治疗的效价比,尤其在降低并发症及医疗费用等方面更为明显[62]。国内研究也显示,对于食管肿瘤接受放、化疗的患者,营养支持治疗团队的参与有利于维持患者的营养状况,提高患者治疗的依从性,缩短住院时间,降低住院费用[63]。
问题11:全程规范化营养支持治疗卫生经济学效益如何?
推荐意见13:建立在筛查和评估基础上的全程规范化营养支持治疗,不仅可改善营养代谢和临床结局,还可产生良好的卫生经济学效益(证据A,强推荐,100.0%)。
全程营养管理即将规范化的“筛查、评估、诊断、干预和监测”贯穿于疾病诊断、治疗及康复的全过程,从而将营养治疗的效率和产出最大化,即在满足患者临床受益的基础上,优化医疗成本与效益比[64]。医学营养治疗包括口服营养补充(ONS)、管饲EN和PN三个部分。2017年的一项系统评价分析了对于住院患者营养支持治疗的成本效益情况,纳入分析的16项研究结果均证明营养支持治疗可节省医疗成本,如其中一项涉及116万例患者的大样本、回顾性研究证明在营养支持治疗上每投入1美元,可节省52.63美元的医疗投入[65]。2020年一项经济学评价显示,对于营养不良患者的医学营养治疗,其住院30 d内的总住院费用比对照组节省199欧元,节省原因主要来自于减少ICU停留时间及并发症的发生[66]。一项纳入超过1 400万例肿瘤生存患者的研究发现应用营养补充的患者与未使用的患者相比,再住院比例显著降低(12%比21%);研究亦显示营养治疗与增加质量调整生命年(QALY)有关,在剩余生存周期平均为13年的情况下,应用营养补充的患者可增加0.48 QALY,仅增加成本2 094美元,具有成本效益;敏感性分析显示营养补充应用6年后,其降低住院率带来的益处已超过其成本[67]。我国针对营养支持治疗的经济学研究的系统评价显示对于有营养风险的患者,相比无营养治疗,营养治疗的成本更高、疗效更好,对应的增量成本效果比(ICER)一般不超过4 000人民币[68]。
问题12:EN适合哪些成人患者?
推荐意见14:存在营养风险和(或)营养不良,且胃肠道有功能且能安全使用的患者,应首选EN;根据疾病和代谢特点制定合理的EN计划,以调理营养代谢,维护脏器功能,改善临床结局(证据A,强推荐,99.3%)。
推荐意见15:能经口进食的患者,首选ONS;无法经口进食或饮食联合ONS无法达到60%能量目标者,可选择管饲EN(证据A,强推荐,98.9%)。
EN是存在营养风险和(或)营养不良,且胃肠道有功能并可安全使用时首选的营养干预方法。ONS是指以增加营养摄入为目的,能为患者提供多种宏量和微量营养素等的液体、半固体或粉剂的营养制剂,加入饮食中或单独服用的营养干预方式。ONS符合生理模式、简便、经济且易于携带,是能经口进食但不能满足机体需求时首选的营养治疗方法。ONS干预方式灵活,可代替部分食物,也可作为加餐以增加摄入。ONS适用人群较为广泛,有营养补充需求并保留基本吞咽及胃肠功能的人群均可应用ONS,如大手术前后、抗肿瘤治疗中、虚弱或肌少症的老年人等[69-71]。多项临床试验和系统评价显示,在医院和社区医疗环境下,ONS均能够改善患者营养状况并从多个方面使患者获益,如增加患者体重、BMI及肌肉力量,改善生活质量[72-75],降低患者病死率和并发症的发生率[76-77];缩短住院时间、降低入院和再入院比例,减少医疗费用支出并提升成本效益[78-80]。
无法经口进食或饮食联合ONS无法达到60%能量目标的患者,可给予管饲EN。其主要适应证如下:(1)不能经口进食、摄食不足或有摄食禁忌者,如口腔、咽峡部或食管肿瘤术后者;烧伤、化学性损伤等造成的吞咽困难者;因疾病导致营养素需要量增加而摄食不足如烧伤、创伤的患者;由于脑血管意外及咽反射丧失而不能吞咽,脑外伤导致中枢神经紊乱、知觉丧失而不能吞咽者;(2)胃肠道疾病,包括胃肠道手术、短肠综合征、胃肠道瘘、炎性肠道疾病、吸收不良综合征、胰腺疾病、结肠手术与诊断准备、神经性厌食或胃瘫等;(3)胃肠外疾病,包括手术前后、肿瘤放、化疗中及肝、肾功能衰竭等。
下列情况不宜应用EN:(1)严重应激状态、上消化道出血、顽固性呕吐、严重腹泻或腹膜炎;(2)完全性肠梗阻及严重胃肠动力障碍。下列情况应慎用EN:(1)严重吸收不良综合征及长期少食衰弱的患者;(2)小肠缺乏足够吸收面积的空肠瘘的患者;(3)休克或昏迷者;(4)胃大部切除后产生倾倒综合征的患者。
问题13:如何选择管饲EN的给予途径?
推荐意见16:鼻胃管适用于接受EN时间<4周的患者;管饲时患者床头抬高30°~45°,可减少吸入性肺炎的发生(证据C,强推荐,98.2%)。
推荐意见17:接受腹部手术且术后需较长时间EN的患者,建议术中放置空肠营养管(证据C,弱推荐,98.2%)。
推荐意见18:其他需要接受>4周的管饲EN的患者,如重度颅脑外伤、卒中或严重吞咽困难等,建议使用经皮内镜下胃造口术(PEG)途径(证据C,强推荐,97.5%)。
为患者选择正确的管饲途径是保证EN安全、有效的基本条件。EN输注途径的选择原则包括:满足EN的需要;置管方式尽量简单、方便;尽量减少对患者的损害;患者舒适并有利于长期带管等。具体方案的选择主要取决于胃肠道解剖的连续性、功能的完整性、EN实施的预计时间及有无误吸风险等因素。
目前国内外尚无关于各类EN管饲途径对患者临床结局影响的多中心RCT研究报告。鼻胃管是最常用的EN管饲途径,适用于胃肠道功能完整、短期行EN且上消化道无梗阻者。将患者床头抬高30°~45°,可减少反流性肺炎的发生[81]。幽门后置管(鼻十二指肠管和鼻空肠管)的适应证与鼻胃管相似,但更适合有胃排空障碍或不适合胃内喂养者,此法明显减少误吸等并发症的发生;对于机械通气患者,幽门后置管还显著降低呼吸机相关肺炎的发生[82-83],但对置管技术和营养液渗透压的要求更高[84-85]。造口置管技术主要适应于需长期EN的患者。胃造口是最常用的长期置管技术之一,适用于各种原因导致的贲门以上进食障碍的患者;空肠造口广泛适用于咽、食管、胃及十二指肠病变不能进食的患者,对有明显胃食管反流、误吸风险、腹部大手术后、胃切除术后及胃排空不良者尤为适用。
对接受腹部外科手术并需要进行EN的患者,建议术中造口置管或留置鼻胃管。对接受食管吻合的患者,空肠置管可显著减少对吻合口的影响,且有利于进行早期EN(EEN)[86-87]。PEG/经皮内镜下空肠造口术(PEJ)符合生理要求,患者无明显不适感,给予营养物质的速度和种类选择灵活,可长期在家庭予以EN。PEG比鼻胃管喂养简单,患者易耐受,EN使用的连续性更好,且可减少食管反流和吸入性肺炎的发生[88]。
问题14:如何选择EN输注方式?
推荐意见19:重症患者和大手术后的患者实施EEN,建议使用EN输注泵连续输注;病情稳定、耐受良好且接受长期EN的患者,建议使用间歇输注法,以恢复正常的饮食节律;若出现不耐受,建议暂停或降低输注速度至原先耐受的水平后,再逐渐增加输注速度,或将间歇输注改为连续输注(证据D,弱推荐,98.6%)。
推荐意见20:对于有高误吸风险的患者,建议使用EN输注泵连续输注,并调控适宜的输注速度,但应避免24 h持续输注(证据D,强推荐,98.6%)。
EN的输注方式包括连续输注和间歇输注等。EN输注速度过快或过慢,一方面可引起患者血糖水平的明显波动,不利于营养物质的吸收和利用,甚至发生高渗性非酮症性昏迷或低血糖反应及其他严重的代谢性并发症;另一方面,可能造成或加重患者的胃肠道症状。治疗初期的输注方式以连续输注为佳,选择低能量密度、低剂量及低速度的方式,可避免大量输注造成的消化道刺激,可有效减少胃潴留、腹泻的发生,并可以为吸收能力受限的患者提供最大程度的营养支持。然而,相较于间歇输注,连续输注可能改变胃内pH水平,导致细菌繁殖。对于有误吸风险的患者,不应24 h持续输注[89]。间歇输注比连续输注更接近正常膳食,使患者在两次给药间有更大的自主时间,还能维持适当的胃内pH水平,刺激胃肠道激素的分泌,有助于促进消化,且有利于糖尿病患者的血糖控制[90]。但间歇输注可能会引起腹胀和腹泻,而且向空肠输送营养液可能会引起倾倒综合征,因此间歇输注时,若出现不耐受等情况,建议改为连续输注[91]。每隔4~6 h使用至少30 ml的生理盐水对EN管路进行冲洗,以避免管路堵塞。
问题15:EN启动时应选用何种配方?
推荐意见21:标准型整蛋白配方适用于大部分患者,大部分重症患者在启动EN时建议使用整蛋白配方;也可根据患者代谢和胃肠道耐受等情况选择不同类型的EN制剂,高蛋白配方有益于部分重症患者的预后;从成分或含量不明确、堵管和感染风险等技术方面考虑,一般不推荐使用家庭制备膳食(证据B,强推荐,98.2%)。
EN制剂按氮源可分为整蛋白型、短肽型和氨基酸型;其中整蛋白型又分为标准型和疾病适用型。国内市售的EN制剂有液体剂(乳剂、混悬液)和粉剂等多种剂型。标准型整蛋白配方成本低、等渗且耐受性好,更加符合饮食标准,适用于需EN支持的胃肠功能基本正常的患者。整蛋白配方(等渗或近等渗)适合于大多数重症患者,且耐受性良好。文献[92-95]报道除了合并高血糖的重症患者使用糖尿病特异型配方,外科大手术患者可使用免疫配方,常规使用特殊配方对一般重症患者的临床结局益处不明显。Suzuki等[96]近年的研究发现应用含高蛋白EN制剂(蛋白质供能比≥20%)的方案使蛋白摄入量>1.2 g·kg-1·d-1的患者与对照组(蛋白摄入量≤1.2 g·kg-1·d-1)相比,接受机械通气的重症患者28 d和90 d的病死率降低了。高脂肪低碳水化合物配方因可降低呼吸商而适用于肺部疾病患者[97],但应避免过度喂养。
问题16:含免疫营养的EN配方适合哪些患者?
推荐意见22:对于接受大手术的营养不良患者(包括肿瘤患者),可在围手术期或至少在术后使用含免疫营养(强化精氨酸、ω-3脂肪酸或核苷酸等)的EN配方(证据B,弱推荐,97.1%)。
一项包括83项RCT研究、含7 116例患者的系统评价证实了围手术期使用含免疫营养的EN配方有助于降低术后并发症的发生率和术后住院天数,尤以营养不良的肿瘤患者为著[98]。相关RCT研究中的免疫调节底物大多包括精氨酸、ω-3脂肪酸和核苷酸等。一项系统评价对术前免疫营养、口服标准营养和无营养补充进行了区分,结果显示术前免疫营养与无营养补充的研究相比,感染性并发症和术后住院天数显著降低[99]。在另一项系统评价中,与正常饮食和等氮标准营养相比,术前使用免疫营养可显著减少术后感染性并发症的发生;在术后住院时长方面,免疫配方与正常饮食相比显著降低,与标准配方相比有下降趋势[100],且有一定的成本-效益优势[101-103]。一项RCT研究显示,相对于标准EN制剂,结、直肠癌患者术前使用免疫调节型EN制剂显著降低切口出血、伤口感染和肺部感染的发生率,并改善患者营养状况[104]。目前尚缺乏足够的有关术前使用含特殊免疫营养配方优于标准型配方的证据。含ω-3多不饱和脂肪酸(ω-3 PUFA)的EN可增加慢性阻塞性肺疾病(COPD)患者的体重、降低炎症反应、减少急性呼吸窘迫综合征(ARDS)患者的通气时间、ICU停留时间和28 d死亡率[105-106];改善脓毒症患者的器官功能并降低死亡率等[107-108];降低重型颅脑损伤并行机械通气患者呼吸机相关性肺炎的发生率、机械通气时间,改善患者病情危重程度、缩短住院天数[109];改善心衰患者的营养状况、心功能并降低炎症反应[110]。
问题17:含膳食纤维的EN配方有何适应证?
推荐意见23:对于一般患者,推荐常规使用含膳食纤维的EN配方(证据C,强推荐,98.2%)。
含膳食纤维的商业化EN配方可以是混合型的(既含有可溶性纤维,也含有不溶性纤维),也可以是非混合型的。在一般成人患者中常规使用含膳食纤维的EN配方有助于促进肠道蠕动,且有助于改善粪便性状,但合并肠狭窄的患者要慎用。对于持续性腹泻患者(除外药物和艰难梭菌感染等原因),使用含混合纤维的配方或仅含可溶性纤维的标准EN配方可能获益[111]。建议膳食纤维摄入量25~30 g/d。不溶性纤维配方可能导致重症患者发生肠梗阻,因此对存在肠缺血或肠梗阻等较高风险的患者应慎用混合纤维配方[112-113]。
问题18:短肽型EN配方有何适应证?
推荐意见24:对于消化吸收功能不全的炎症性肠病患者,初始可考虑短肽型EN配方;合并严重吸收不良或对膳食纤维反应不敏感的腹泻患者,可考虑使用短肽型EN配方;重症胰腺炎、短肠综合征及放射性肠炎等患者,使用短肽型EN配方亦可获益(证据B,强推荐,98.9%)。
短肽型配方易吸收,可改善喂养不耐受的现象,各种高营养风险人群,如克罗恩病、短肠综合征和急、慢性胰腺炎及重症患者的营养治疗获益的情况均有报道[114]。短肽型EN的氮源来自于蛋白质的分解物,更易消化吸收,且残渣少,用于肠功能不全患者的初始EN治疗。对于持续腹泻伴严重吸收不良或对膳食纤维反应不敏感的腹泻患者可使用短肽型配方[115]。有研究显示,等渗短肽型EN配方的营养吸收率显著高于传统短肽制剂[116]。一项前瞻性研究指出,给予活动性克罗恩病患者短肽配方治疗12周后,营养状态显著改善;白蛋白和BMI升高;Harvey-Bradshaw指数显著下降;大便次数减少[117]。对急性胰腺炎患者进行的一项RCT研究发现,短肽型和整蛋白型配方都是安全的,且耐受性良好;短肽型配方在住院时长和体重维持方面较标准整蛋白型配方疗效更佳;对于重症急性胰腺炎且存在吸收不良的患者,使用短肽型EN制剂是可获益的[118]。
问题19:特定疾病的EN配方适合哪些成人患者?
推荐意见25:肝硬化患者可使用富含支链氨基酸(BCAAs)的EN配方;对于已接受乳果糖治疗的肝昏迷患者,无证据表明使用富含BCAAs的EN配方可改善患者的肝昏迷等级(证据C,弱推荐,99.6%)。
推荐意见26:糖尿病型EN配方(DSF)有益于血糖控制,减轻胰岛素抵抗,减少胰岛素用量,可改善临床结局(证据B,强推荐,97.8%)。
推荐意见27:肿瘤型EN配方富含ω-3 PUFA,可下调炎症反应并维持肿瘤患者体重与营养状态,可使临床获益(证据B,强推荐,97.8%)。
随机试验结果表明,长期口服(1或2年)BCAAs可延缓肝脏疾病和(或)衰竭的进展,延长无事件生存期[119-121];但在已接受乳果糖治疗的肝性脑病患者中,尚无证据表明添加BCAAs能进一步改善其精神状态或昏迷等级[119,122]。
糖尿病型EN配方含有基础营养成分,同时添加缓释淀粉、果糖、膳食纤维和单不饱和脂肪酸等,以此延缓葡萄糖的吸收,减少血糖的波动。一项系统评价显示,与标准EN制剂相比,DSF可更好地控制血糖、减少胰岛素用量[123]。一项纳入6年间有高血糖的重症急性胰腺炎患者的研究发现,与标准EN制剂相比,含缓释淀粉和果糖的DSF可显著控制血糖、减少ICU住院时间和总住院时间,并降低60 d和90 d死亡率[95]。另一项纳入伴2型糖尿病且使用DSF的ICU患者的研究显示,与未接受DSF治疗的患者相比,接受DSF的2型糖尿病患者死亡率显著降低,胰岛素处方需求亦降低,ICU住院总费用明显更低[94]。胰岛素是治疗高血糖的首选药物,但DSF亦可控制血糖、减少胰岛素用量,从而减少高血糖事件的发生,并降低患者的住院总费用。
肿瘤型EN配方提高了脂肪供能比(50%),富含ω-3 PUFA,可改善食欲,维持体重和(或)肌肉量,且具有抗炎作用,故可能防治肿瘤的恶病质。对于接受化疗且有体重丢失风险或营养不良风险的恶性肿瘤患者,可补充ω-3 PUFA,以稳定或改善食欲,增加食物摄入、肌肉量和体重,减轻化疗反应[124-125]。一项包含35项研究的系统评价报告了3 692例因消化道肿瘤(包括胃癌、结直肠癌、食管癌、壶腹周围癌或胰腺癌等)接受手术的患者,与对照组相比,含ω-3 PUFA等免疫营养组分的EN可降低总并发症(如感染性并发症、吻合口瘘等),缩短住院时间[126]。
问题20:微生态制剂是否可应用于临床?
推荐意见28:特定疾患使用微生态制剂是有益和安全的;但基于目前的研究结果,无法对普通患者或重症患者常规使用微生态制剂作出推荐意见(证据B,弱推荐,98.9%)。
微生态制剂指富含益生菌或益生元及合生元等益生菌制剂,由对人体有益的正常微生物或调节代谢的物质制备而成。有系统评价表明以乳酸杆菌为基础的微生态制剂可降低肿瘤患者抗肿瘤治疗过程中出现的腹泻的严重程度和频率,减少止泻药物的使用[127],降低围手术期感染的发生率[128],并减少住院费用[129]。最新一项系统评价显示益生菌或合生元治疗组呼吸机相关性肺炎和脓毒症发生率显著降低;亚组分析表明其发生率的降低与接受合生元治疗有关,而单独给予益生菌的患者其发生率并未显著降低;但治疗组的病死率、腹泻发生率和ICU住院时长并未降低[130]。多项研究表明使用益生菌可发生其他感染[127-131]。由于不同的研究中使用的微生态制剂、使用时长和研究人群的异质性,无法对普通患者或ICU患者常规使用微生态制剂作出统一的推荐意见。
问题21:如何监测接受EN治疗的患者的耐受性?
推荐意见29:EN治疗期间,应每天监测患者对EN的耐受性,包括主诉、体格检查和胃肠功能评估等(证据C,强推荐,99.6%)。
推荐意见30:EN治疗期间,重症患者不需常规监测胃残留量(GRV)(证据A,强推荐,93.5%)。
EN不耐受的定义尚未统一,常描述为出现一系列如恶心、呕吐、腹胀、腹泻、便秘等胃肠道不耐受的症状,以及高GRV,并有可能中断EN治疗。一项回顾性队列研究发现,所有出现EN不耐受的患者中,约2/3的患者仅表现为高GRV,而1/3的患者同时出现2种或2种以上的胃肠道症状[132]。另外一项研究发现,全面衡量胃肠道症状,而非仅关注单一指标,更能全面地评估ICU患者的EN耐受情况[133]。因此,有必要结合体格检查、胃肠功能评估及主诉等综合评估EN治疗的耐受性。
有关探讨GRV与呼吸机相关肺炎关系的研究,包括一项系统评价、两项RCT研究[134-135]和一项病例对照研究[136],均证明不监测GRV并不会显著增加肺炎的发生风险。一项系统评价指出,监测GRV是导致不必要的EN治疗中断的常见原因,且GRV升高并不等同于胃肠道不耐受,取消监测GRV甚至能显著改善胃肠道的耐受性[137-138];GRV升高并非总提示误吸风险高[139];且不监测GRV能更快地达到喂养目标[140]。若部分重症患者需监测GRV,也应适当提高GRV阈值,有研究指出,较高水平的GRV阈值(250~500 ml)并不会增加反流、误吸或肺炎等并发症的风险[139]。最近的一项前瞻性观察研究发现,经床旁超声测量得到的胃窦横截面积与导致误吸的GRV呈线性增加关系[141],床旁超声可能比经胃管抽吸更能准确评估GRV。
问题22:EN治疗期间如何预防误吸的发生?
推荐意见31:接受EN治疗的患者应进行误吸风险评估;对高危患者,可采取以下干预措施:(1)由胃内喂养改为幽门后喂养;(2)由间歇性改为持续喂养;(3)定期口腔护理;(4)使用促胃肠动力药物(证据C,强推荐,98.9%)。
误吸是EN治疗的严重并发症之一,可增加肺炎甚至死亡的风险。当存在以下情况时,患者误吸的风险增加:高龄(年龄>70岁)、机械通气口腔护理不良、重度老年痴呆、意识水平降低、吞咽困难、因肺部疾病长期处于仰卧位、胃食管反流和间歇性大剂量推注肠内营养液等[142-143]。多项RCT研究显示,与胃内喂养相比,幽门后喂养患者呼吸机相关肺炎的发生率显著降低[82-83,144-149]。多个小样本RCT研究表明,与间歇推注相比,持续输注时EN中断更少且摄入量更高,但两种输注方式对患者的临床结局的影响差异无统计意义[150-151]。研究表明,0.12%氯己定漱口液(2次/d)可优化口腔健康,并可减少心脏术后患者呼吸道感染和医院内肺炎的发生率[152-153]。多项系统评价和一项病例交叉研究结果显示,促胃肠动力药物可显著改善因EN治疗导致胃肠道动力不足的现象,但并不能改善肺炎、ICU住院天数和死亡率等临床结局[154-156]。
问题23:EN治疗期间如何应对腹泻?
推荐意见32:EN治疗期间发生的腹泻应首先排除疾病或非营养药物性原因,而非停止EN(证据C,强推荐,98.9%)。
腹泻是EN治疗的常见并发症,严重者可出现电解质紊乱、脱水、肛周皮肤破裂和伤口污染等不良事件。接受EN治疗的患者中,超过一半的腹泻病例与服用含山梨醇的药物有关[157]。此外,富含短链碳水化合物(可发酵低聚糖、双糖和单糖、多元醇等)的EN配方也可导致腹泻,归因于吸收不良且肠道细菌快速发酵产气[158]。EN治疗期间出现腹泻,应首先排除疾病或非营养药物性原因,可在继续EN的情况下寻找腹泻原因而停止EN。明确腹泻原因后,可对因治疗。
EN相关腹泻的干预措施包括改用短肽配方和联合益生菌治疗。有关短肽型配方和标准配方对消化道术后患者的研究发现,短肽型配方组的腹泻发生率显著低于对照组,保证了EN的顺利进行[159]。也有研究发现,等渗短肽型EN配方可改善患者粪便硬度和排便次数,并提高患者的生活质量[160-161]。与单独使用EN制剂相比,EN制剂联合复合益生菌组的机械通气患者腹泻发生率明显降低,更有利于EN治疗的顺利进行[162-163]。
问题24:如何管理重症患者的EN支持治疗?
推荐意见33:建议对无法维持自主进食的重症患者,在血流动力学稳定的情况下,应在入住ICU的48 h内开始进行EEN支持治疗(证据B,强推荐,98.2%)。
推荐意见34:以下情况重症患者需延迟启动EN支持治疗:(1)休克未得到有效控制,血流动力学及组织灌注未达到目标时;(2)存在危及生命的低氧血症、高碳酸血症或酸中毒时;(3)活动性上消化道出血;(4)肠道缺血;(5)肠瘘引流量大,且无法建立达到瘘口远端的营养途径时;(6)肠梗阻;(7)腹腔间隔室综合征;(9)GRV>500 ml/6 h(证据D,弱推荐,99.3%)。
推荐意见35:以下情况需给予低剂量(滋养性)EN支持治疗:(1)接受低温治疗;(2)存在腹腔高压但无腹腔间隔室综合征;EN治疗过程中出现腹内压持续增高时需暂停EN;(3)合并急性肝功能衰竭;(4)使用液体复苏或小剂量血管活性药物后循环稳定的患者(证据D,弱推荐,98.6%)。
许多国内外肠外肠内营养实践指南推荐重症患者使用EEN。Heyland等[164]对8项RCT研究进行的一项系统评价显示,与延迟EN相比,24~48 h内予以EN治疗可降低感染性并发症的发生率及死亡率。Tian等[165]对纳入的3 225例受试者的16项研究进行了系统评价,结果显示在ICU住院24 h内进行EN并未降低死亡率,但发生肺炎的可能性较低;亚组分析显示,EEN与延迟EN相比,可明显降低死亡率,而EEN和PN间的死亡率差异无统计学意义。另一方面,国外的系统评价常只纳入英文文献,对国内肠外肠内营养实践的参考价值欠充分,有必要在国内开展多中心临床研究,获得针对国人的临床证据。故无法维持自主进食的重症成人患者,应在48 h内进行EEN,而非延迟EN。
对于休克尚未控制的情况,建议延迟使用EN,因为休克后EN会进一步加重已受损的内脏组织灌注,可导致非闭塞性肠坏死或非闭塞性肠系膜缺血(NOMI)的发生[166-167],但尚无证据表明休克、血管加压药、EN与NOMI间存在因果关系[166-169]。因此,不推荐血流动力学非常不稳定的患者使用EN。对于低氧血症、高碳酸血症和酸中毒患者,EN可增加氧气的消耗和CO2的产生,故这类患者需限制使用EN。一项系统评价和一项烧伤回顾性研究均提示EN是应激性溃疡和胃肠道出血的保护因素[170-171]。对于再出血风险较高的患者,EN可延迟48~72 h[172]。
EN不耐受或高流量瘘导致皮肤破溃或液体/电解质失衡是减少或停止EN的明显原因[173]。若无法在瘘管远端获得可靠的喂养通路,建议延迟予以高流量的肠瘘患者EN治疗。未发现针对腹腔间隔室综合征患者使用EN的前瞻性研究[174]。由于腹腔间隔室综合征是危及内脏灌注且时刻危及生命的疾病,建议保留或停止EN并尝试降低腹内压。
由于低温和应用镇痛剂导致肠道动力下降,低温期间肠内喂养的耐受性可能受损,但在复温期间有所改善[175]。在暴发性肝功能衰竭中延迟EN治疗的病理生理学原理是功能严重受损的肝脏存在营养代谢障碍,应避免氨的额外增加。一项大型观察性研究中,与晚期EN治疗(>48 h)相比,液体复苏后血流动力学稳定的患者实施EEN(<48 h)与死亡率降低相关,而这些患者同时接受一种以上血管加压药的治疗[176]。这些结果表明,尽管喂养不耐受的发生率很高,但使用血管加压药时不应将EN排除在外(尤其是处于病情稳定或血管加压药剂量减少阶段)[177]。
问题25:成人外科患者的EN如何管理?
推荐意见36:高营养风险或中重度营养不良的患者应接受术前营养支持治疗,治疗时间为7~14 d(证据B,强推荐,99.3%)。
推荐意见37:为减少手术并发症,术前和术后ONS适合以下患者:(1)进食不足;(2)合并营养风险或营养不良;(3)合并肌少症;(4)各种原因导致的衰弱患者;(5)髋部骨折等患者(证据B,强推荐,99.6%)。
推荐意见38:多数患者不需手术前夜即禁食,麻醉前6 h可进软食、2 h可进清流质;术前碳水化合物负荷可降低患者饥饿、不适及焦虑感,改善术后胰岛素抵抗(证据B,强推荐,97.5%)。
推荐意见39:对于多数患者,术后早期(24 h内)可经口摄入营养;无法经口自主进食、预计进食量不足(<目标量的60%)超过7 d的患者,术后24 h内可予以EN(证据B,强推荐,98.9%)。
推荐意见40:对于大手术后出院的患者,应监测其营养摄入与体重变化,存在营养风险/营养不良者,在饮食指导的基础上给予ONS(证据B,强推荐,99.6%)。
术前营养支持的疗效与患者术前的营养状况密切相关。对于营养状态良好的患者来说,围手术期营养支持治疗对其并无获益;而重度营养不良的患者可从术前营养支持治疗中获益[178-179]。一项系统评价纳入29项研究共7 176例患者,结果表明肌少症导致胃肠肿瘤患者术后并发症的风险增加[180]。而一项纳入56项临床研究的系统评价表明,围手术期营养补充能降低术后感染和非感染性并发症的发生率,缩短胃肠肿瘤手术患者的住院时间[181]。术前营养支持治疗的指征:(1)6个月内体重丢失>10%~15%;(2)BMI<18.5 kg/m2;(3)SGA分级为C或NRS 2002>5分;(4)血清白蛋白<30 g/L(排除肝、肾功能不全)[182, 183]。在加速康复外科(ERAS)理念的指导下,术前进行2~6周的三模式预康复(包括营养支持治疗、体能锻炼和心理支持)为术后并发症发生风险高的患者提供新的治疗方法[184-185]。
一项多中心RCT研究表明,入院前给予下消化道手术患者ONS,可显著减少术后体重丢失,并能减少并发症[186];而且给予住院患者标准的ONS,亦有较高的经济效益[79,186]。老年人由于器官功能逐渐衰弱、合并多种疾病等因素,易存在营养风险或发生营养不良,导致术后不良的结局,应尽早进行营养干预。一项纳入41项随机试验,涉及3 881例髋部骨折老年患者的系统评价结果显示,ONS显著增加患者的能量和营养的摄入,其中使用ONS的11项试验的汇总分析表明,术后并发症的风险降低[187]。
传统观点认为,术前长时间禁饮食可降低麻醉期间反流误吸的风险,但尚无明确证据支持手术前长时间禁食可避免反流误吸的发生。相反,长时间禁饮食可导致机体糖代谢紊乱、内稳态失衡,增加患者应激反应,导致患者产生焦虑情绪,不利于术中和术后的液体管理。术前口服碳水化合物(手术前1晚予800 ml;麻醉诱导前2~3 h予400 ml)可减轻夜间禁食和手术导致的分解代谢反应[188-189],且减少术后蛋白的丢失,更好地维持肌肉量和肌肉力量,改善术后胰岛素抵抗[190-192]。目前多个国家的麻醉学会已更新了指南,推荐择期手术患者术前2 h可给予清流质[193-194]。需强调的是,对于存在特殊风险的急诊手术患者、存在胃排空延迟或胃食管反流的患者,术前禁饮食时间仍需谨慎考虑。目前对于肥胖、糖尿病患者术前饮用碳水化合物的安全性和临床获益性的研究较少,有待更多大型临床研究提供证据支持。
术后早期进食是ERAS非常重要的一项措施,多项系统评价显示术后早期进食可显著降低并发症的发生率并缩短住院时间[195-196],且未增加死亡率、吻合口瘘及肠功能延迟恢复等负性临床结局风险[197-199]。需注意的是,初始经口营养摄入量要根据患者胃肠道功能状态和个体耐受情况进行调整,应密切评估胃肠功能受损患者EN的耐受情况。无法经口自主进食、预计进食量不足(<目标量的60%)超过7 d的患者,可在术后24 h内可予以EN支持治疗[183]。
尽管对患者进行了围手术期营养支持治疗,但许多存在营养风险或营养不良的外科患者无法在较短的住院期间内完全改善其营养状况。另外,由于术后并发症等原因,患者体重丢失,营养状况可能进一步恶化,出院时仍存在营养风险或营养不良。一项对18项食管切除术患者的系统评价显示,术后6个月患者体重减轻了5%~12%。超过一半的患者在12个月内体重下降了10%[200]。这些患者出院后需继续进行营养随访和必要的干预。ONS简单方便,适合院外患者的使用,使用持续时间根据患者的营养状况和后续治疗情况而定。一项RCT研究发现,有营养风险的结、直肠癌术后患者使用ONS 3个月,可减少骨骼肌丢失和肌少症的发生率,并提高化疗耐受性[201]。住院期间及出院后90 d内给予营养不良的老年患者高蛋白ONS,可改善患者的营养状况并降低死亡率[76]。
问题26:PN适用于哪些患者?
推荐意见41:PN适用于无法通过口服和(或)肠内途径满足其营养需求的患者(证据A,强推荐,99.3%)。
推荐意见42:对于需要营养支持治疗的患者,若EN提供的能量和蛋白质低于机体目标需要量的60%,通过补充性PN(SPN)增加能量及蛋白质摄入量,以减低或避免喂养不足,改善临床结局(证据A,强推荐,98.6%)。
推荐意见43:对于肠功能衰竭、短肠综合征、肠缺血、高流量瘘及腹腔间隔室综合征等患者,建议使用PN(证据B,强推荐,96.8%)。
推荐意见44:PN可改善晚期肿瘤患者的营养不良状态(证据C,弱推荐,96.8%)。
既往研究发现使用PN的患者比使用EN会出现更高的感染率、更长的住院时间、更高的费用,甚至增加病死率[202],因此多数指南推荐对于有肠道功能的患者更应该使用EN[54,164]。但近期有部分学者发现PN导致感染的原因可能是过度喂养,并非PN本身[202-203]。同时,许多患者由于疾病或治疗的原因,EN常难以达到机体每日的实际需要量,因此造成机体能量或蛋白质的不足,这些情况在重症患者中尤为明显。一项包含29个国家2 920例重症患者的临床研究发现,单纯给予EN后患者热量及蛋白质充足率分别为63.4%和59.3%,显著低于PN组患者(81.2%和80.1%,P<0.001)[204]。Yeh等[205]对外科ICU单纯给予EN时间超过3 d的患者进行研究,结果显示能量和蛋白质供给明显不足,而喂养不足同样是不良临床结局的重要因素。因此,在EN不能满足患者的能量和蛋白质需要时,通过PN补充不足部分的能量及蛋白质已得到临床及国内外指南的认可[23,54,183]。
合理的PN治疗可弥补因EN补充不足所造成的机体对能量和蛋白质的需求,从而有利于维护组织的正常代谢和组织器官功能,特别是重症状态下细胞自噬的修复,从而改善患者的临床结局[206]。Bauer等[207]研究显示,与EN联合安慰剂组相比,经过7 d的营养支持治疗,EN联合PN组促进蛋白质合成并缩短住院时间,但90 d病死率差异无统计学意义。2020年发表的一篇系统评价结果显示,当EN不能满足重症成人患者的能量需求时,SPN在增加能量和蛋白质摄入的同时,可降低医源性感染及ICU病死率[208]。因此,尽管SPN的使用存在一些争议,但对于无法耐受EN或者EN无法达到目标需要量60%以上的患者,SPN仍然是重要的营养支持治疗方式。
对于肠梗阻、明显肠缺血、高流量瘘、严重肠道出血及腹腔间室综合征等重症患者建议先行PN,暂缓EN[183]。肿瘤晚期的患者多数存在吞咽困难甚至恶性肠梗阻,PN可延长生存时间[209]。近期一项RCT研究表明,PN治疗可以明显改善胃肠道肿瘤晚期患者的生活质量[210]。
问题27:如何确定PN的启动时机?
推荐意见45:对于营养风险较高的患者(NRS 2002≥5分,NUTRIC≥6分),若48~72 h内EN无法满足机体需要的能量及蛋白质的60%时,建议给予SPN;对于胃肠功能严重障碍且不能使用EN的重度营养不良患者,建议尽早启动PN(证据B,强推荐,98.2%)。
推荐意见46:对于低营养风险的患者(3分≤NRS 2002<5分或NUTRIC<6分),EN支持治疗7 d后仍未能达到60%目标喂养量时,应给予SPN(证据A,强推荐,99.3%)。
如何确定PN的最佳启动时机是肠外肠内营养领域争论和关注的热点,不同国际营养学会指南在PN启动时机的推荐意见上也不完全一致。ESPEN指南推荐,实施EN 2~3 d后能量和蛋白质仍未达到目标量时,应在48 h内启动PN[211]。ASPEN指南认为,无论营养风险如何,EN提供的能量和蛋白质无法达到目标需要量的60%时,应该在1周后启动PN[18]。Casaer等[212]的研究显示,EN供给不足的患者,入住ICU后晚期(入住ICU后第8天)给予SPN治疗的患者比早期(第3天)的住院时间更短,且感染发生率、住院费用等也较早期组更低;但由于该研究选取的患者中60%均有心脏手术史,且排除了BMI<20 kg/m2的患者等原因,其结论存在争议。一篇包含4项RCT、2项观察性研究的系统评价中,在其他并发症发生率和死亡率上,早期进行SPN(<48 h)较晚期(>8 d)无明显优势;其中一项RCT研究发现晚期给予SPN的患者ICU住院时间更短,考虑到PN费用较高等问题,不推荐早期实施SPN[213]。Doig等[214]一项RCT研究发现早期给予重症患者PN治疗可降低气管插管的天数;与晚期PN组比较,生存时间差异无统计学意义。有研究将患者随机分为EN和PN组,两组均在第3天开始给予营养干预,均维持5 d,结果显示两组患者30 d内并发症发生率差异无统计学意义[215]。另有研究显示对于血流动力学不稳定需要机械通气的重症患者来说,早期EN组与早期PN组的死亡率与感染率差别无统计学意义,而EN组患者的胃肠道并发症的风险更高[216]。Gao等[217]最新发表的RCT研究显示,早期SPN(72 h内)可减少腹部手术患者的术后感染性并发症的发生。
由于重症患者的个体差异较大,导致PN启动时机的结论不一致。目前多种评估工具将患者分为低风险和高风险营养不良组,例如NRS 2002和NUTRIC评分[218]。一项关于317例急诊腹部手术的重症患者的研究发现,对于mNUTRIC评分≥5或BMI<18.5 kg/m2的高危险组患者,48 h内给予SPN的患者30 d死亡率及院内死亡率显著低于晚期组(>8 d);而两组肺炎等感染性并发症的发生率差异无统计学意义;而早期或晚期给予SPN对低危险组患者的临床结局并无影响[219]。AGIⅢ级的患者建议尽早启动全PN(TPN)[38]。
问题28:如何确定PN处方中葡萄糖与脂肪供能的比例?
推荐意见47:重症或外科术后患者急性期应避免过高的糖脂比,以免加重糖代谢紊乱,脂肪供能一般为非蛋白热卡的30%~50%(证据B,强推荐,99.6%)。
葡萄糖、脂肪乳剂是PN处方中主要的供能物质,一般建议脂肪供给为1.0~1.5 g·kg-1·d-1,葡萄糖为3.0~5.0 g·kg-1·d-1,糖脂比通常为60/40或70/30,重症患者可达50/50,且有脂肪供能达60%的报道[220]。这是由于重症或外科术后患者常合并应激性高血糖,与应激状态下葡萄糖氧化代谢障碍、糖异生增强及胰岛素抵抗、外周组织糖利用障碍有关,尤其急性期早期(入住ICU后1~3 d内),过多葡萄糖摄入可加重糖代谢紊乱与器官功能损害。一项多中心、前瞻性随机研究纳入47例接受TPN的重症患者,结果表明高糖脂比(80/20)较低糖脂比(50/50)仅有轻微的节氮效应,但血糖及γ-谷氨酰转肽酶明显升高[221]。因此,重症患者PN时需适当降低糖脂比,避免葡萄糖摄入过多而加重糖代谢紊乱,并在监测血糖的情况下应用胰岛素控制血糖。PN时还需注意控制葡萄糖输注速率(2~2.5 mg·kg-1·min-1),葡萄糖输注速度>4 mg·kg-1·min-1(5.7 g·kg-1·d-1)时,增加机体氧化代谢的负担,造成肝脏脂肪变性。一项纳入44例长期PN患者的研究发现,59.1%的患者发生PN相关性肝病(PNALD),多元回归分析显示碳水化合物摄入是发生PNALD的独立危险因素之一[222]。因此即便是非ICU患者,长期PN时亦需监测肝功能以调整糖脂比,减少PN相关的肝损伤。氨基酸作为机体的氮源,建议以足量的非蛋白热卡供给为基础,避免浪费;推荐使用不含亚硫酸盐类抗氧化剂的复方氨基酸制剂以减少肝损害。
问题29:PN处方中脂肪乳剂如何选择?
推荐意见48:与大豆油长链脂肪乳剂相比,中/长链脂肪乳剂可改善脂代谢、减轻免疫抑制反应;结构脂肪乳剂可均衡代谢,保护肝功能;鱼油脂肪乳剂可调控机体炎症反应,改善器官功能;橄榄油脂肪乳剂可减轻脂质过氧化;多种油脂肪乳剂(SMOF)优化脂肪酸配方,利于临床获益(证据B,弱推荐,98.9%)。
脂肪乳剂可为机体供能并提供必需脂肪酸,减少高糖输注相关的代谢性并发症。一项系统评价证实使用含脂肪乳剂的PN可显著降低营养不良的外科患者术后并发症[223]。尽管PN处方中常规推荐使用脂肪乳剂,但对于有严重高脂血症或脂代谢障碍的患者,应根据患者的代谢状况决定是否应用脂肪乳剂,且应充分权衡其可能的风险与获益。大豆油来源的长链脂肪乳剂的临床耐受性较好,居PN处方量之首,但其富含ω-6 PUFA,体内代谢会产生炎性细胞因子,促进血小板聚集,抑制淋巴细胞、单核细胞及中性粒细胞的增殖和活性,导致炎症反应失衡、免疫功能受损。与长链脂肪酸相比,中链脂肪酸水溶性更强,更易被脂肪酶水解,在血液循环中的清除速度更快,半衰期仅为长链脂肪酸的一半;且不依赖肉毒碱转运,直接进入肝脏线粒体进行氧化分解;还可刺激胰岛β-细胞释放胰岛素,改善机体对葡萄糖的利用,减少糖异生,有显著的节氮效应;此外还可减少炎性介质的产生、维持细胞膜磷脂构成,避免免疫及吞噬细胞功能受抑制。由于中链脂肪酸是饱和脂肪酸,且不含必需脂肪酸,因此临床上多使用中/长链脂肪乳以兼顾两者的特点,其中结构脂肪乳通过水解再酯化的工艺,使脂肪酸的水解速度更均匀,有利于脂肪廓清和保护肝功能。Li等[224]纳入32项研究共1 944例患者的系统评价发现,在接受PN治疗的中国患者中,与物理混合的中/长链脂肪乳相比,结构脂肪乳剂可改善肝功能、营养状况和免疫功能,缩短住院时间并减少不良事件发生。鱼油脂肪乳中富含ω-3 PUFA,有独特的抗炎和免疫调节作用,多个研究证实其能减少外科患者炎性因子水平,降低感染发生率,并缩短住院时间,维护器官功能[225-227]。橄榄油脂肪乳中包括80%的橄榄油和20%的大豆油,其脂肪酸的构成为73% ω-9 PUFA、11%多不饱和脂肪酸和16%的饱和脂肪酸,可减轻脂质过氧化,保护线粒体和细胞[228]。SMOF中包括30%的大豆油、30%椰子油、25%橄榄油、15%鱼油和维生素E,优化脂肪酸配方有利于脂肪廓清,改善临床结局[229-230]。
问题30:PN处方中是否需要常规添加谷氨酰胺(Gln)双肽?
推荐意见49:外科和重症患者肠道无法进行喂养时,PN添加Gln双肽可维护肠黏膜屏障功能和免疫功能,减少感染性并发症(证据A,强推荐,97.8%)。
推荐意见50:合并严重肝、肾功能障碍和休克的重症患者,不建议补充Gln双肽(证据A,强推荐,99.3%)。
通过PN途径添加的Gln多采用双肽的剂型,多项RCT研究推荐Gln双肽补充剂量为0.3~0.5 g·kg-1·d-1,不超过氨基酸总量的30%。两项系统评价中,一项纳入14个RCT研究共587例外科患者,一项纳入40个RCT研究共约2 000例患者,均提示经肠外途径补充Gln双肽可降低感染相关并发症的发生并减少住院时间[231-232]。另一项系统评价纳入117个RCT研究共计9 933例ICU患者,其结果显示PN添加Gln双肽可减少感染性并发症的发生,对病死率与ICU住院时间无影响[233]。而合并严重器官功能障碍的患者,尤其是脓毒症休克或合并肝、肾功能不全者,补充Gln易增加重症患者的病死率[234],Gln浓度过低(<400 μmol/L)或过高(≥700 μmol/L)病死率均明显升高[235]。因此,合并多器官功能障碍的重症患者,尤其是肝、肾功能衰竭者,不宜补充Gln;在监测Gln浓度下实现个体化的补充,可能获得更好的临床结果[236]。
问题31:PN处方中是否需添加ω-3 PUFA?
推荐意见51:需要PN的外科和重症患者,添加ω-3 PUFA有助于调控炎症反应,降低感染发生率,缩短住院时间(证据A,强推荐,97.8%)。
大量研究显示ω-3 PUFA参与炎症反应的调控,且与补充剂量(0.1~0.2 g·kg-1·d-1)和ω-6/ω-3 PUFA比例有关。正常PN中都有脂肪乳,以ω-6 PUFA为主,一项系统评价纳入31个RCT研究包含1 450例患者,结果显示补充低比例的ω-6/ω-3 PUFA(2.5∶1)明显降低肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)水平[237]。因此,重症患者PN添加ω-3 PUFA有调控炎症反应、改善机体免疫功能的作用。一项系统评价共纳入13个RCT研究892例患者,术后均接受添加ω-3 PUFA的PN治疗,结果显示减少了术后感染性并发症并降低住院时间[238]。近年发表的系统评价纳入了49个RCT研究包括外科、ICU住院患者,其中70%以上的能量供给来源于PN,结果显示添加ω-3 PUFA(ω-6/ω-3 PUFA=2~4/1)的PN感染风险降低了40%,减少ICU停留时间与住院总时间;且部分RCT研究显示脓毒症发生风险降低了56%,但对病死率无影响[225]。
问题32:“全合一”PN有哪些临床优势?
推荐意见52:与单瓶输注相比,“全合一”PN可减少代谢性并发症的发生,降低相关感染风险,更符合机体生理代谢过程,是PN建议的应用模式(证据B,强推荐,98.9%)。
与单瓶输注相比较,“全合一”PN中各种营养成分充分混合,使之达到合理的配比,更加符合病理生理需求,有利于机体的合成代谢需要[220]。能量物质和氨基酸同时输注可避免氨基酸作为能源物质被消耗,这种输注方式避免了某一阶段某种营养物质输入较多而另一种(些)营养物质输注较少时而产生的不良反应。充分混匀的营养物质可以使各营养剂相互稀释,降低整体渗透压,减少对静脉的刺激。此外“全合一”溶液中的氨基酸分子可吸附在油水界面上,增强了乳糜微粒的机械屏障,增强脂肪乳剂的稳定性。
“全合一”PN可避免更换输液瓶和插入导气针,使用方便,有效降低临床操作时产生的污染和气栓的风险,减少血流感染的发生[239]。Pan等[240]研究证实,与无营养治疗相比,“全合一”模式可使治疗相关的不良事件发生率减少44%,而单瓶输注则明显增加不良事件的发生。
问题33:PN多腔袋(MCB)的特点和临床优势?
推荐意见53:MCB有多种规格,均具有处方较为合理、严格的质量标准和即开即用等特点,减少处方和配置错误,降低微生物污染和血流感染的发生,满足多数患者的PN需求;规范使用MCB可节省人力成本,缩短住院时间,降低医疗费用,有较好的卫生经济学效益(证据B,强推荐,98.3%)。
推荐意见54:对于需严格限制液体和电解质摄入、存在严重的代谢紊乱、有特殊营养素和液体量需求的患者,建议给予院内配制的个体化PN处方(证据C,强推荐,99.3%)。
“全合一”PN混合液包括处方生成后在静脉用药调配中心完成的“院内配置”和工业化生产的PN MCB两种形式,适合不同的患者。PN MCB也称即用型预混式MCB,MCB制剂中一般包含所有的宏营养素和部分微营养素,其处方原则源于PN临床应用实践。MCB的生产过程有严格的质量标准,即开即用,简单方便。“院内配置”PN混合液由于需要将十余种制剂混合,即使有标准化操作规程,PN混合配制过程中发生差错的风险也较高。文献报道手工配制的差错率为37%,自动配制为22%,主要表现为遗漏药物、成分剂量错误等[241]。MCB制剂简化了配置过程,可不加药或仅需添加少许维生素和电解质,减少了处方生成和配置差错。陈伟等[242]研究证实,目前国内MCB制剂可满足大部分住院患者PN的处方需求。但对于一些特殊人群(如儿童、老年患者)及特殊疾病状态的患者,应给予以病情为指导的个体化营养治疗[243]。
由于MCB混合后即可使用,简化了静脉药物配置过程。虽然“院内配置”PN在符合《药品生产质量管理规范》要求的静脉用药调配中心进行配置,但环境和静脉制剂包装材料中产生的微粒,不可避免地会带入PN混合液中;特别是环境中的微生物,如细菌、病毒和真菌等,在配置过程中易污染PN混合液,导致血流感染的发生。美国一项回顾性研究统计了2005年1月1日至2007年12月31日期间接受PN的68 984例住院患者,比较组间血流感染发生率的差异:MCB组和PN组(接受医院内或外部集中配制中心配制)的血流感染发生率分别为17.5%和26.6%[244]。Turpin等[245]回顾性研究分析2009年10月至2011年4月期间住院并接受PN治疗的1 995例患者,发现使用单瓶/多瓶序贯输注和“院内配制”的PN患者,血流感染的发生风险分别为使用MCB的2.46倍和1.84倍。
MCB与“院内配置”相比,可减少感染性并发症的发生并节省人力成本。系统评价证实与“院内配置”及多瓶输注相比,MCB疗效更佳并减少人力成本,具有较好的卫生经济学效益[246]。Durand-Zaleski等[247]通过对菌血症的住院花费和TPN直接成本建模发现,当菌血症每日风险绝对降低达到0.3%的阈值时,MCB即可产生净收益。Yu等[248]研究证实了MCB的有效性和安全性,且临床使用方便,节省时间。Turpin等[245]研究发现住院患者使用MCB不会增加治疗成本,其原因可能与使用MCB后感染的风险降低有关。
问题34:PN处方中是否应包括多种维生素和微量元素?
推荐意见55:PN处方中应添加常规剂量的多种维生素和微量元素及电解质;添加时应考虑与营养液中其他成分相容性和制剂的稳定性(证据C,强推荐,99.6%)。
电解质、维生素及微量元素是PN重要的组成成分,对维持机体水、电解质和酸碱平衡、保持人体内环境稳定起着十分重要的作用,这些添加剂应根据稳定性和相容性数据在无菌条件下完成。MCB可在输注前由经过适当培训的护理人员进行添加。PN微量元素的补充,建议优先选择铜含量较低、硒含量较高,渗透压较低,且输注时间更灵活的多种微量元素制剂,以便满足各种患者的治疗需求。应每日常规添加多种维生素,推荐使用包含人体所必需的脂溶性维生素和水溶性维生素,可减少配液步骤,减少污染风险,提高用药安全。在某些需要补充超出正常剂量的电解质、维生素或微量元素的特定情况下,应采用易于使用且经过验证的方法检查其稳定性(如混合物中的油/水稳定性)[220]。建议使用有机钙和磷盐配制PN溶液,以防沉淀[249]。为减少药物不相容性,建议维生素在输注周期结束时添加或单独使用[250]。
问题35:如何选择PN的输注途径?
推荐意见56:应根据混合后的PN液渗透压摩尔浓度选择外周静脉(≤900 mOsm/L)或中心静脉输注(>900 mOsm/L);建议使用公式估算成人PN液渗透压摩尔浓度(证据B,强推荐,99.3%)。
推荐意见57:中心静脉导管尖端应放置在右心房与上腔静脉交界处的水平,右侧入路优先于左侧入路,以降低血栓形成风险;单腔静脉导管可降低导管阻塞或感染的发生率;经外周静脉置入中心静脉导管的穿刺风险较低,感染性并发症较少,是较长时间PN输注的主要途径(证据B,强推荐,98.6%)。
渗透压摩尔浓度是每升溶液中含有渗透活性粒子(分子或离子)的数量(毫摩尔),单位为mOsm/L或mOsm/kg。正常人体血液的渗透压摩尔浓度范围为285~310 mOsm/kg,外周输注高渗透压摩尔浓度的液体时,易发生血栓性静脉炎,因而推荐渗透压摩尔浓度≤900 mOsm/L的PN液体可经外周静脉输注;而>900 mOsm/L则应通过中心静脉输注[23,251]。渗透压摩尔浓度可使用冰点渗透压仪测定,也可通过公式估算。推荐简便公式估算PN液体的渗透压摩尔浓度,即[葡萄糖(g)×5+氨基酸(g)×10+20%脂肪乳(g)×(1.3~1.5)+电解质(mmol)]/总体积(L)[252]。当添加药品后,PN MCB的渗透压摩尔浓度需重新判断,静脉输注时,需确保同一静脉通路的药物相容性,必要时咨询临床药师。
国内共识推荐中心静脉血管通路装置可作为PN的主要输注途径[253]。经皮穿刺的中心静脉置管适合重症患者,首选锁骨下静脉途径,建议使用时间<30 d;经外周置入中心静脉导管(PICC)穿刺风险较低,感染性并发症较少,是较长时间(>30 d)PN输注的主要途径[23]。近年的系统评价显示,与隧道式中心静脉置管和输液港相比,PICC不会增加导管相关血流感染的发生率[254-255]。无论是通过颈内静脉、锁骨下静脉或是PICC途径,均应将导管的尖端放置于右心房和上腔静脉的交界水平(相当于右侧第3肋骨上缘水平),以减少血栓并发症的发生。有研究发现右侧置管较左侧置管降低了静脉血栓形成的风险[256-257]。有文献报道,多腔中心静脉导管较单腔导管更易发生感染[258-259]。
问题36:如何使用PN输注泵?
推荐意见58:建议采用循环输注法实施PN,有条件者使用输液泵控制输注速度;与固定输液泵相比,便携式泵可提高家庭PN(HPN)者的生活质量(证据D,弱推荐,98.9%)。
PN的输注通常采用循环输注法,即选择每天在同一时间段内输注营养液,同时监测机体对葡萄糖和液体量的耐受情况[260]。PN液输注的速度应快慢适宜,根据不同情况控制在8~20 h/d,有利于减少代谢性并发症的发生。输液泵的引入是PN安全管理的主要原因之一。作为一种医疗设备,它可将营养物质以可控的量和速度输送到患者体内。PN为高渗性液体且液体量较大,包含较高浓度的葡萄糖和钾离子等电解质,快速给药或“自由流动”会对患者造成严重的伤害[252]。因此,应尽可能使用输液泵来管理和监控PN的输送。输注过程中一旦出现故障或液体即将输注完毕,仪器会自动报警,保证了输液的安全,对夜间输液的患者尤为重要[260]。
两项使用便携式可移动输液泵的研究发现,便携式输液泵为HPN患者提供了自行输液的机会,增加了其参加社交活动和工作的可能性,并提高了生活质量。如果可移动输液泵不可用或不适用,带有静脉支架的标准容量泵也是一种替代方案[261-262]。
问题37:如何处理PN并发症?
推荐意见59:PN相关感染性并发症多由于静脉导管、肠源性和配置过程污染,规范选择导管途径和标准化维护、尽可能恢复肠内喂养是预防感染的重要举措;预防性应用抗生素对预防导管相关感染无益(证据B,强推荐,99.6%)。
推荐意见60:较长时间PN治疗易发生PNALD,尽早启动肠内喂养、优化PN处方、控制感染及合理使用保肝药物是防治的重要方法(证据B,强推荐,99.3%)。
随着PN使用时间的延长,感染几率势必增加,PN的感染性并发症多由于静脉导管、肠源性、配置或加药过程污染,输注葡萄糖导致的高血糖也是其原因之一[244,263]。中心静脉导管相关血流感染(CRBSI)是PN治疗时最常见和最严重的并发症,严重时可导致感染性休克甚至死亡。研究发现,导管相关性感染的主要感染源来自于导管接头处,局部或全身预防性应用抗生素对预防导管相关感染并无优势[264]。一项HPN回顾性研究发现,通过中心静脉导管采集血样是CRBSI发生的重要危险因素之一[265]。另一项回顾性研究分析了452个用于抗生素给药的完全植入性中心静脉装置,结果发现通过该装置进行常规血液采样与血管堵塞、血栓形成和感染所致的血管装置移除有关[266]。
长期TPN可损害肠黏膜屏障功能,肠道细菌移位引起肠源性感染。规范静脉导管管理和规范使用EN是减少PN感染性并发症的关键措施[253]。静脉药物配置过程中PN液污染,是导致血流感染的重要因素,而工业化生产的MCB导致的感染较少。两项关于MCB与“院内配置”对比的回顾性研究均提示前者在减少血流感染方面的优势[244-245]。一项RCT研究显示,MCB组血液感染和中央静脉导管相关血流感染人数均显著低于院内配置组[267]。
长期PN易引起肝功能损害,即PNALD,其病理生理改变主要为淤胆和肝脏脂肪浸润,临床表现为胆汁淤积、肝酶谱升高和黄疸,严重者可导致不可逆的肝损害,甚至引起肝衰竭及死亡[268]。PNALD是多因素综合作用的结果,包括原发疾病的影响、胃肠道长时间缺乏食物刺激、胆汁淤积、长期过高的能量供给,葡萄糖、脂肪与氮量的配比不合理及营养制剂中的某些成分的影响等。为减少肝功能损害的发生,应避免长时间过高热量及过量葡萄糖的摄入,适当调整PN处方,如使用中/长链或结构脂肪乳剂或鱼油脂肪乳剂[269-270]。Xu等[271]在15例接受HPN且伴有PNALD的患者中用鱼油替代部分大豆油脂肪乳,发现有12例4周内直接胆红素恢复正常,4周后总胆红素和直接胆红素水平均较基线显著下降,所有患者的肝功能和脂肪酸均有改善,连续的肝活检标本均显示进行性的组织学改善。牛磺酸可与胆汁酸结合预防胆汁淤积,对于重症、大手术和短肠综合征等牛磺酸水平较低的患者,外源性补充效果更佳[272]。在允许的情况下,尽可能保持经口进食或经胃肠道支持喂养,补充熊去氧胆酸等利胆药物以减少胆汁淤积均可减少肝功能损害的发生[273]。
本指南在制定过程中参考了最新的研究进展及相关指南,并通过专家组多次讨论审阅而最终成稿,为临床医生提供参考。本指南仅代表参与编写讨论专家的观点,不具备法律效力。指南发布后,CSPEN将随时关注相关领域的证据变化情况,按照指南方法学要求,每年回顾相关推荐意见的证据变化,根据变化情况组织本领域专家对推荐意见进行相应修订,一般情况下每3~5年对指南进行一次全面修订。
本指南制定专家委员会名单
执笔者:杨桦(重庆市人民医院普外科);朱明炜(北普外科);陈伟(北京协和医院临床营养科);王新颖(东部战区总医院普外科);余震(上海第十人民医院普外科);李增宁(河北医科大学第一医院临床营养科);周建平(中国医科大学附属第一医院胃肠外科);周岩冰(青岛大学附属医院胃肠外科);彭俊生(中山大学附属第六医院胃肠外科);陈莲珍(中国医学科学院肿瘤医院药学部);许红霞(陆军军医大学附属大坪医院临床营养科);李孟彬(第一附属医院胃肠外科);江华(四川省人民医院急诊外科);高纯(华中科技大学同济医学院附属同济医院胃肠外科);梁斌(北京大学人民医院胃肠外科);邵春海(复旦大学附属华山医院营养科);周华(北京清华长庚医院重症医学科);贾震易(上海第六人民医院普外科)
审定专家(按姓氏汉语拼音排序):蔡常洁(中山大学附属第一医院重症医学科);陈尔真(上海交通大学瑞金医院重症医学科);陈俊强(广西医科大学附一院胃肠外科);陈志康(中南大学湘雅医院普外科);崔红元(北普外科);黄河(山西医科大学第一医院普外科);靖昌庆(山东省立医院普外科);康维明(北京协和医院基本外科);郎韧(首都医科大学北京朝阳医院肝胆外科);李明松(广州医科大学附三院消化科);李幼生(上海第九人民医院普外科);李元新(北京清华长庚医院胃肠外科);马晓薇(宁夏医科大学总医院心脑血管病医院重症医学科);孟庆华(首都医科大学附属北京佑安医院重症肝病科);秦环龙(上海第十人民医院普外科);沈威(南昌大学附二院胃肠外科);沈贤(温州医科大学附一院普外科);王烈(联勤保障第900医院普外科);韦军民(北普外科);肖卫东(陆军军医大学新桥医院胃肠外科);许爱国(郑州大学附属第一医院重症医学科);阎庆辉(河北医科大学附二院普通外科);尤丕聪(天津医院重症医学科);张常华(中山大学附属第七医院胃肠外科);张片红(浙江大学医学院附二院临床营养科);张有成(兰州大学第二医院普外科);周业平(北京积水潭医院烧伤外科)
学术秘书:陈丽如(北临床营养科);李融融(北京协和医院临床营养科);章黎(东部战区总医院普外科);陈国庆(重庆市人民医院普外科);王宇(四川省人民医院急诊外科)
利益冲突
所有作者均声明不存在利益冲突
参考文献(下滑查看):
[1]陈耀龙, 杨克虎, 王小钦, 等. 中国制订/修订临床诊疗指南的指导原则(2022版)[J]. 中华医学杂志, 2022, 102(10):697-703. DOI: 10.3760/cma.j.cn112137-20211228-02911.
[2]BrouwersMC, KhoME, BrowmanGP, et al. AGREEⅡ: advancing guideline development, reporting and evaluation in health care[J]. CMAJ, 2010, 182(18):E839-E842. DOI: 10.1503/cmaj.090449.
[3]GuyattGH, OxmanAD, VistGE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations[J]. BMJ, 2008, 336(7650):924-926. DOI: 10.1136/bmj.39489.470347.AD.
[4]蒋朱明, 张献娜, 王怡, 等. 营养不良GLIM诊断标准第一步是营养筛查及按中国疾病代码填写营养风险、营养不良于出院病案首页等注意事项[J]. 中华临床营养杂志, 2020, 28(5):257-267. DOI: 10.3760/cma.j.cn115822-20200920-00216.
[5]崔红元, 朱明炜, 陈伟, 等. 中国老年住院患者营养状态的多中心调查研究[J]. 中华老年医学杂志, 2021, 40(3):364-369. DOI: 10.3760/cma.j.issn.0254-9026.2021.03.019.
[6]杨鑫, 崔红元, 陈伟, 等. 普通外科病人住院期间营养风险和营养不良动态变化的多中心横断面调查[J]. 肠外与肠内营养, 2020, 27(5):270-273. DOI: 10.16151/j.1007-810x.2020.05.004.
[7]AbateSM, ChekoleYA, EstifanosMB, et al. Prevalence and outcomes of malnutrition among hospitalized COVID-19 patients: a systematic review and meta-analysis[J]. Clin Nutr ESPEN, 2021, 43:174-183. DOI: 10.1016/j.clnesp.2021.03.002.
[8]AhmedSI, JiangZM, NolanMT, et al. Impact of nutritional support on clinical outcome in patients at nutritional risk: a multicenter, prospective cohort study in Baltimore and Beijing teaching hospitals[J]. Nutrition, 2010, 26(11-12):1088-1093. DOI: 10.1016/j.nut.2009.08.027.
[9]ZhangH, WangY, JiangZM, et al. Impact of nutrition support on clinical outcome and cost-effectiveness analysis in patients at nutritional risk: a prospective cohort study with propensity score matching[J]. Nutrition, 2017, 37:53-59. DOI: 10.1016/j.nut.2016.12.004.
[10]Erratum to 'The impact of nutrition support on clinical outcome and cost-effectiveness analysis in patients at nutritional risk: a prospective cohort study with propensity score matching,' Nutrition (2017) 37C, 53-59[J]. Nutrition, 2017, 42:121. DOI: 10.1016/j.nut.2017.04.001.
[11]LomerM, CahillO, BaschaliA, et al. A multicentre study of nutrition risk assessment in adult patients with inflammatory bowel disease attending outpatient clinics[J]. Ann Nutr Metab, 2019, 74(1):18-23. DOI: 10.1159/000495214.
[12]KangJ, LiH, ShiX, et al. Efficacy of malnutrition screening tools in China for elderly outpatients[J]. Asia Pac J Clin Nutr, 2021, 30(1):1-6. DOI: 10.6133/apjcn.202103_30(1).0001.
[13]KangJ, LiH, ShiX, et al. Validation of the efficacy of the nutriscore for the nutritional screening of cancer patients in China[J]. BMC Cancer, 2022, 22(1):43. DOI: 10.1186/s12885-021-09135-2.
[14]JensenGL, CederholmT, CorreiaM, et al. GLIM criteria for the diagnosis of malnutrition: a consensus report from the Global Clinical Nutrition Community[J]. JPEN J Parenter Enteral Nutr, 2019, 43(1):32-40. DOI: 10.1002/jpen.1440.
[15]KondrupJ, RasmussenHH, HambergO, et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials[J]. Clin Nutr, 2003, 22(3):321-336. DOI: 10.1016/s0261-5614(02)00214-5.
[16]JieB, JiangZM, NolanMT, et al. Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk[J]. Nutrition, 2012, 28(10):1022-1027. DOI: 10.1016/j.nut.2012.01.017.
[17]ZhuM, WeiJ, ChenW, et al. Nutritional risk and nutritional status at admission and discharge among Chinese hospitalized patients: a prospective, nationwide, multicenter study[J]. J Am Coll Nutr, 2017, 36(5):357-363. DOI: 10.1080/07315724.2017.1304293.
[18]TaylorBE, McClaveSA, MartindaleRG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.)[J]. Crit Care Med, 2016, 44(2):390-438. DOI: 10.1097/CCM.0000000000001525.
[19]许静涌, 杨剑, 康维明, 等. 营养风险及营养风险筛查工具营养风险筛查2002临床应用专家共识(2018版)[J]. 中华临床营养杂志, 2018, 26(3):131-135. DOI: 10.3760/cma.j.issn.1674-635X.2018.03.001.
[20]RubensteinLZ, HarkerJO, SalvàA, et al. Screening for undernutrition in geriatric practice: developing the short-form mini-nutritional assessment (MNA-SF)[J]. J Gerontol A Biol Sci Med Sci, 2001, 56(6):M366-M372. DOI: 10.1093/gerona/56.6.m366.
[21]KaiserMJ, BauerJM, RamschC, et al. Validation of the mini nutritional assessment short-form (MNA-SF): a practical tool for identification of nutritional status[J]. J Nutr Health Aging, 2009, 13(9):782-788. DOI: 10.1007/s12603-009-0214-7.
[22]MuellerC, CompherC, EllenDM. A.S.P.E.N. clinical guidelines: nutrition screening, assessment, and intervention in adults[J]. JPEN J Parenter Enteral Nutr, 2011, 35(1):16-24. DOI: 10.1177/0148607110389335.
[23]中华医学会肠外肠内营养学分会老年营养支持学组. 中国老年患者肠外肠内营养应用指南(2020)[J]. 中华老年医学杂志, 2020, 39(2):119-132. DOI: 10.3760/cma.j.issn.0254-9026.2020.02.002.
[24]StrattonRJ, HackstonA, LongmoreD, et al. Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the 'malnutrition universal screening tool' ('MUST') for adults[J]. Br J Nutr, 2004, 92(5):799-808. DOI: 10.1079/bjn20041258.
[25]CederholmT, BarazzoniR, AustinP, et al. ESPEN guidelines on definitions and terminology of clinical nutrition[J]. Clin Nutr, 2017, 36(1):49-64. DOI: 10.1016/j.clnu.2016.09.004.
[26]Machado Dos ReisA, MarchettiJ, Forte Dos SantosA, et al. NUTRIC score: isolated and combined use with the NRS-2002 to predict hospital mortality in critically ill patients[J]. JPEN J Parenter Enteral Nutr, 2020, 44(7):1250-1256. DOI: 10.1002/jpen.1804.
[27]MajariK, ImaniH, HosseiniS, et al. Comparison of modified NUTRIC, NRS-2002, and MUST scores in iranian critically ill patients admitted to intensive care units: a prospective cohort study[J]. JPEN J Parenter Enteral Nutr, 2021, 45(7):1504-1513. DOI: 10.1002/jpen.2031.
[28]AllardJP, KellerH, GramlichL, et al. GLIM criteria has fair sensitivity and specificity for diagnosing malnutrition when using SGA as comparator[J]. Clin Nutr, 2020, 39(9):2771-2777. DOI: 10.1016/j.clnu.2019.12.004.
[29]KakavasS, KarayiannisD, BouloubasiZ, et al. Global leadership initiative on malnutrition criteria predict pulmonary complications and 90-day mortality after major abdominal surgery in cancer patients[J]. Nutrients, 2020, 12(12):3726. DOI: 10.3390/nu12123726.
[30]BalciC, BolayirB, EşmeM, et al. Comparison of the efficacy of the global leadership initiative on malnutrition criteria, subjective global assessment, and nutrition risk screening 2002 in diagnosing malnutrition and predicting 5-year mortality in patients hospitalized for acute illnesses[J]. JPEN J Parenter Enteral Nutr, 2021, 45(6):1172-1180. DOI: 10.1002/jpen.2016.
[31]HainesKL, LaoW, NguyenBP, et al. Evaluation of malnutrition via modified GLIM criteria for in patients undergoing emergent gastrointestinal surgery[J]. Clin Nutr, 2021, 40(3):1367-1375. DOI: 10.1016/j.clnu.2020.08.026.
[32]SongHN, WangWB, LuoX, et al. Effect of GLIM-defined malnutrition on postoperative clinical outcomes in patients with colorectal cancer[J]. Jpn J Clin Oncol, 2022, 52(5):466-474. DOI: 10.1093/jjco/hyab215.
[33]TanS, WangJ, ZhouF, et al. Validation of GLIM malnutrition criteria in cancer patients undergoing major abdominal surgery: a large-scale prospective study[J]. Clin Nutr, 2022, 41(3):599-609. DOI: 10.1016/j.clnu.2022.01.010.
[34]许静涌, 杨剑, 陈伟, 等. 老年肿瘤住院患者营养不良的横断面调查[J]. 中华老年医学杂志, 2019, 38(11):1298-1303. DOI: 10.3760/cma.j.issn.0254-9026.2019.11.026.
[35]谈善军, 严明月, 王俊杰, 等. 营养不良诊断GLIM标准在国内外的应用现状与展望[J]. 中华临床营养杂志, 2022, 30(1):53-60. DOI: 10.3760/cma.j.cn115822-20210512-00104.
[36]Soriano-MorenoDR, Dolores-MaldonadoG, Benites-BullónA, et al. Recommendations for nutritional assessment across clinical practice guidelines: a scoping review[J]. Clin Nutr ESPEN, 2022, 49:201-207. DOI: 10.1016/j.clnesp.2022.04.023.
[37]ReintamA, ParmP, KitusR, et al. Gastrointestinal symptoms in intensive care patients[J]. Acta Anaesthesiol Scand, 2009, 53(3):318-324. DOI: 10.1111/j.1399-6576.2008.01860.x.
[38]Reintam BlaserA, MalbrainML, StarkopfJ, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3):384-394. DOI: 10.1007/s00134-011-2459-y.
[39]LiH, LuJ, LiH, et al. Association between nutrition support and acute gastrointestinal injury in critically ill patients during the first 72 hours[J]. Clin Nutr, 2021, 40(1):217-221. DOI: 10.1016/j.clnu.2020.05.011.
[40]HuB, SunR, WuA, et al. Severity of acute gastrointestinal injury grade is a predictor of all-cause mortality in critically ill patients: a multicenter, prospective, observational study[J]. Crit Care, 2017, 21(1):188. DOI: 10.1186/s13054-017-1780-4.
[41]WangL, YangH, LvG, et al. Association of gastric antrum echodensity and acute gastrointestinal injury in critically ill patients[J]. Nutrients, 2022, 14(3):566. DOI: 10.3390/nu14030566.
[42]孙亚梅, 李楠. 对再喂养综合征的认识及高危患者的预防[J]. 胃肠病学和肝病学杂志, 2017, 26(2):231-233. DOI: 10.3969/j.issn.1006-5709.2017.02.031.
[43]da SilvaJ, SeresDS, SabinoK, et al. ASPEN consensus recommendations for refeeding syndrome[J]. Nutr Clin Pract, 2020, 35(2):178-195. DOI: 10.1002/ncp.10474.
[44]HakeamHA, MuliaHA, AzzamA, et al. Glargine insulin use versus continuous regular insulin in diabetic surgical noncritically ill patients receiving parenteral nutrition: randomized controlled study[J]. JPEN J Parenter Enteral Nutr, 2017, 41(7):1110-1118. DOI: 10.1177/0148607116644710.
[45]McCullochA, BansiyaV, WoodwardJM. Addition of insulin to parenteral nutrition for control of hyperglycemia[J]. JPEN J Parenter Enteral Nutr, 2018, 42(5):846-854. DOI: 10.1177/0148607117722750.
[46]Sion-SaridR, CohenJ, HouriZ, et al. Indirect calorimetry: a guide for optimizing nutritional support in the critically ill child[J]. Nutrition, 2013, 29(9):1094-1099. DOI: 10.1016/j.nut.2013.03.013.
[47]ZusmanO, KaganI, BendavidI, et al. Predictive equations versus measured energy expenditure by indirect calorimetry: a retrospective validation[J]. Clin Nutr, 2019, 38(3):1206-1210. DOI: 10.1016/j.clnu.2018.04.020.
[48]中华医学会肠外肠内营养学分会. 肠外营养多腔袋临床应用专家共识(2022)[J]. 中华外科杂志, 2022, 60(4):321-328. DOI: 10.3760/cma.j.cn112139-20211228-00624.
[49]WeijsPJ, LooijaardWG, BeishuizenA, et al. Early high protein intake is associated with low mortality and energy overfeeding with high mortality in non-septic mechanically ventilated critically ill patients[J]. Crit Care, 2014, 18(6):701. DOI: 10.1186/s13054-014-0701-z.
[50]FerrieS, Allman-FarinelliM, DaleyM, et al. Protein requirements in the critically ill: a randomized controlled trial using parenteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2016, 40(6):795-805. DOI: 10.1177/0148607115618449.
[51]NakamuraK, NakanoH, NarabaH, et al. High protein versus medium protein delivery under equal total energy delivery in critical care: a randomized controlled trial[J]. Clin Nutr, 2021, 40(3):796-803. DOI: 10.1016/j.clnu.2020.07.036.
[52]O′KeefeGE, SheltonM, QiuQ, et al. Increasing enteral protein intake in critically ill trauma and surgical patients[J]. Nutr Clin Pract, 2019, 34(5):751-759. DOI: 10.1002/ncp.10256.
[53]CompherC, BinghamAL, McCallM, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: the american society for parenteral and enteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2022, 46(1):12-41. DOI: 10.1002/jpen.2267.
[54]SingerP, BlaserAR, BergerMM, et al. ESPEN guideline on clinical nutrition in the intensive care unit[J]. Clin Nutr, 2019, 38(1):48-79. DOI: 10.1016/j.clnu.2018.08.037.
[55]ChoiEY, ParkDA, ParkJ. Calorie intake of enteral nutrition and clinical outcomes in acutely critically ill patients: a meta-analysis of randomized controlled trials[J]. JPEN J Parenter Enteral Nutr, 2015, 39(3):291-300. DOI: 10.1177/0148607114544322.
[56]TianF, WangX, GaoX, et al. Effect of initial calorie intake via enteral nutrition in critical illness: a meta-analysis of randomised controlled trials[J]. Crit Care, 2015, 19(1):180. DOI: 10.1186/s13054-015-0902-0.
[57]TsaiJR, ChangWT, SheuCC, et al. Inadequate energy delivery during early critical illness correlates with increased risk of mortality in patients who survive at least seven days: a retrospective study[J]. Clin Nutr, 2011, 30(2):209-214. DOI: 10.1016/j.clnu.2010.09.003.
[58]HeylandDK, StephensKE, DayAG, et al. The success of enteral nutrition and ICU-acquired infections: a multicenter observational study[J]. Clin Nutr, 2011, 30(2):148-155. DOI: 10.1016/j.clnu.2010.09.011.
[59]KissCM, Byham-GrayL, DenmarkR, et al. The impact of implementation of a nutrition support algorithm on nutrition care outcomes in an intensive care unit[J]. Nutr Clin Pract, 2012, 27(6):793-801. DOI: 10.1177/0884533612457178.
[60]中华医学会肠外肠内营养学分会, 营养风险-不足-支持-结局-成本/效果多中心协作组, 张献娜, 等. 营养风险筛查和全球(营养)领导人发起的营养不良诊断(GLIM)第二、三步流程(共识2020)[J]. 中华临床营养杂志, 2020, 28(4):193-200. DOI: 10.3760/cma.j.cn115822-20200824-00199.
[61]DeLeggeMH, KellyAT. State of nutrition support teams[J]. Nutr Clin Pract, 2013, 28(6):691-697. DOI: 10.1177/0884533613507455.
[62]MistiaenP, Van den HeedeK. Nutrition support teams: a systematic review[J]. JPEN J Parenter Enteral Nutr, 2020, 44(6):1004-1020. DOI: 10.1002/jpen.1811.
[63]丛明华, 李淑娈, 程国威, 等. 营养支持小组对于食管癌同步放化疗患者作用的研究[J]. 中国肿瘤临床, 2014, (18):1158-1162. DOI: 10.3969/j.issn.1000-8179.20141364.
[64]朱明炜, 陈丽如. 价值医疗理念下的医学营养疗法[J]. 中华临床营养杂志, 2022, 30(3):129-133. DOI: 10.3760/cma.j.cn115822-20220304-00043.
[65]MuscaritoliM, KrznarićZ, SingerP, et al. Effectiveness and efficacy of nutritional therapy: a systematic review following Cochrane methodology[J]. Clin Nutr, 2017, 36(4):939-957. DOI: 10.1016/j.clnu.2016.06.022.
[66]SchuetzP, SuloS, WalzerS, et al. Economic evaluation of individualized nutritional support in medical inpatients: secondary analysis of the effort trial[J]. Clin Nutr, 2020, 39(11):3361-3368. DOI: 10.1016/j.clnu.2020.02.023.
[67]ShaverAL, TufuorTA, NieJ, et al. Cost-effectiveness of nutrient supplementation in cancer survivors[J]. Cancers (Basel), 2021, 13(24):6276. DOI: 10.3390/cancers13246276.
[68]王沛. 我国医学营养治疗经济学评价的系统性综述[J]. 卫生经济研究, 2020, 37(7):16-21.
[69]StrattonRJ, EliaM. Encouraging appropriate, evidence-based use of oral nutritional supplements[J]. Proc Nutr Soc, 2010, 69(4):477-487. DOI: 10.1017/S0029665110001977.
[70]StreicherM, Themessl-HuberM, SchindlerK, et al. Who receives oral nutritional supplements in nursing homes? Results from the nutritionDay project[J]. Clin Nutr, 2017, 36(5):1360-1371. DOI: 10.1016/j.clnu.2016.09.005.
[71]DupuyC, de Souto BarretoP, GhisolfiA, et al. Indicators of oral nutritional supplements prescription in nursing home residents: a cross-sectional study[J]. Clin Nutr, 2016, 35(5):1047-1052. DOI: 10.1016/j.clnu.2015.07.015.
[72]CawoodAL, EliaM, StrattonRJ. Systematic review and meta-analysis of the effects of high protein oral nutritional supplements[J]. Ageing Res Rev, 2012, 11(2):278-296. DOI: 10.1016/j.arr.2011.12.008.
[73]CramerJT, Cruz-JentoftAJ, LandiF, et al. Impacts of high-protein oral nutritional supplements among malnourished men and women with sarcopenia: a multicenter, randomized, double-blinded, controlled trial[J]. J Am Med Dir Assoc, 2016, 17(11):1044-1055. DOI: 10.1016/j.jamda.2016.08.009.
[74]BaldwinC, SpiroA, AhernR, et al. Oral nutritional interventions in malnourished patients with cancer: a systematic review and meta-analysis[J]. J Natl Cancer Inst, 2012, 104(5):371-385. DOI: 10.1093/jnci/djr556.
[75]JiangW, DingH, LiW, et al. Benefits of oral nutritional supplements in patients with locally advanced nasopharyngeal cancer during concurrent chemoradiotherapy: an exploratory prospective randomized trial[J]. Nutr Cancer, 2018, 70(8):1299-1307. DOI: 10.1080/01635581.2018.1557222.
[76]DeutzNE, MathesonEM, MatareseLE, et al. Readmission and mortality in malnourished, older, hospitalized adults treated with a specialized oral nutritional supplement: a randomized clinical trial[J]. Clin Nutr, 2016, 35(1):18-26. DOI: 10.1016/j.clnu.2015.12.010.
[77]KnightSR, QureshiAU, DrakeTM, et al. The impact of preoperative oral nutrition supplementation on outcomes in patients undergoing gastrointestinal surgery for cancer in low-and middle-income countries: a systematic review and meta-analysis[J]. Sci Rep, 2022, 12(1):12456. DOI: 10.1038/s41598-022-16460-4.
[78]EliaM, NormandC, LavianoA, et al. A systematic review of the cost and cost effectiveness of using standard oral nutritional supplements in community and care home settings[J]. Clin Nutr, 2016, 35(1):125-137. DOI: 10.1016/j.clnu.2015.07.012.
[79]EliaM, NormandC, NormanK, et al. A systematic review of the cost and cost effectiveness of using standard oral nutritional supplements in the hospital setting[J]. Clin Nutr, 2016, 35(2):370-380. DOI: 10.1016/j.clnu.2015.05.010.
[80]ZhongY, CohenJT, GoatesS, et al. The cost-effectiveness of oral nutrition supplementation for malnourished older hospital patients[J]. Appl Health Econ Health Policy, 2017, 15(1):75-83. DOI: 10.1007/s40258-016-0269-7.
[81]WirekoBM, BowlingT. Enteral tube feeding[J]. Clin Med (Lond), 2010, 10(6):616-619. DOI: 10.7861/clinmedicine.10-6-616.
[82]GeW, WeiW, ShuangP, et al. Nasointestinal tube in mechanical ventilation patients is more advantageous[J]. Open Med (Wars), 2019, 14:426-430. DOI: 10.1515/med-2019-0045.
[83]LiZ, QiJ, ZhaoX, et al. Risk-benefit profile of gastric vs transpyloric feeding in mechanically ventilated patients: a meta-analysis[J]. Nutr Clin Pract, 2016, 31(1):91-98. DOI: 10.1177/0884533615595593.
[84]LiuY, WangY, ZhangB, et al. Gastric-tube versus post-pyloric feeding in critical patients: a systematic review and meta-analysis of pulmonary aspiration-and nutrition-related outcomes[J]. Eur J Clin Nutr, 2021, 75(9):1337-1348. DOI: 10.1038/s41430-021-00860-2.
[85]ZhangZ, XuX, DingJ, et al. Comparison of postpyloric tube feeding and gastric tube feeding in intensive care unit patients: a meta-analysis[J]. Nutr Clin Pract, 2013, 28(3):371-380. DOI: 10.1177/0884533613485987.
[86]TaoZ, ZhangY, ZhuS, et al. A prospective randomized trial comparing jejunostomy and nasogastric feeding in minimally invasive mckeown esophagectomy[J]. J Gastrointest Surg, 2020, 24(10):2187-2196. DOI: 10.1007/s11605-019-04390-y.
[87]HolménA, HayamiM, SzaboE, et al. Nutritional jejunostomy in esophagectomy for cancer, a national register-based cohort study of associations with postoperative outcomes and survival[J]. Langenbecks Arch Surg, 2021, 406(5):1415-1423. DOI: 10.1007/s00423-020-02037-0.
[88]LöserC, AschlG, HébuterneX, et al. ESPEN guidelines on artificial enteral nutrition--percutaneous endoscopic gastrostomy (PEG)[J]. Clin Nutr, 2005, 24(5):848-861. DOI: 10.1016/j.clnu.2005.06.013.
[89]StroudM, DuncanH, NightingaleJ. Guidelines for enteral feeding in adult hospital patients[J]. Gut, 2003, 52 (Suppl 7):vii1-vii12. DOI: 10.1136/gut.52.suppl_7.vii1.
[90]HooperMH, MarikPE. Controversies and misconceptions in intensive care unit nutrition[J]. Clin Chest Med, 2015, 36(3):409-418. DOI: 10.1016/j.ccm.2015.05.013.
[91]Winnipeg Regional Health Authority. Adult Enteral Nutrition Clinical Practice Guideline[EB/OL]. (2017-03-04) [2022-09-10]. https://professionals.wrha./old/extranet/eipt/files/EIPT-34-005.pdf.
[92]MarikPE, ZalogaGP. Immunonutrition in critically ill patients: a systematic review and analysis of the literature[J]. Intensive Care Med, 2008, 34(11):1980-1990. DOI: 10.1007/s00134-008-1213-6.
[93]MesejoA, Montejo-GonzálezJC, Vaquerizo-AlonsoC, et al. Diabetes-specific enteral nutrition formula in hyperglycemic, mechanically ventilated, critically ill patients: a prospective, open-label, blind-randomized, multicenter study[J]. Crit Care, 2015, 19:390. DOI: 10.1186/s13054-015-1108-1.
[94]HanYY, LaiSR, PartridgeJS, et al. The clinical and economic impact of the use of diabetes-specific enteral formula on ICU patients with type 2 diabetes[J]. Clin Nutr, 2017, 36(6):1567-1572. DOI: 10.1016/j.clnu.2016.09.027.
[95]ZhangH, LiL, WuJ, et al. Enteral nutrition preparations for blood glucose variability and prognosis for severe acute pancreatitis with stress hyperglycemia[J]. Altern Ther Health Med, 2023, 29(1):163-169.
[96]SuzukiG, IchibayashiR, YamamotoS, et al. Effect of high-protein nutrition in critically ill patients: a retrospective cohort study[J]. Clin Nutr ESPEN, 2020, 38:111-117. DOI: 10.1016/j.clnesp.2020.05.022.
[97]CaiB, ZhuY, YiM, et al. Effect of supplementing a high-fat, low-carbohydrate enteral formula in COPD patients[J]. Nutrition, 2003, 19(3):229-232. DOI: 10.1016/s0899-9007(02)01064-x.
[98]ProbstP, OhmannS, KlaiberU, et al. Meta-analysis of immunonutrition in major abdominal surgery[J]. Br J Surg, 2017, 104(12):1594-1608. DOI: 10.1002/bjs.10659.
[99]HegaziRA, HusteadDS, EvansDC. Preoperative standard oral nutrition supplements vs immunonutrition: results of a systematic review and meta-analysis[J]. J Am Coll Surg, 2014, 219(5):1078-1087. DOI: 10.1016/j.jamcollsurg.2014.06.016.
[100]AdiamahA, SkořepaP, WeimannA, et al. The impact of preoperative immune modulating nutrition on outcomes in patients undergoing surgery for gastrointestinal cancer: a systematic review and meta-analysis[J]. Ann Surg, 2019, 270(2):247-256. DOI: 10.1097/SLA.0000000000003256.
[101]BragaM, GianottiL. Preoperative immunonutrition: cost-benefit analysis[J]. JPEN J Parenter Enteral Nutr, 2005, 29(1Suppl):S57-S61. DOI: 10.1177/01486071050290S1S57.
[102]StricklandA, BroganA, KraussJ, et al. Is the use of specialized nutritional formulations a cost-effective strategy? A national database evaluation[J]. JPEN J Parenter Enteral Nutr, 2005, 29(1Suppl):S81-S91. DOI: 10.1177/01486071050290S1S81.
[103]Chevrou-SéveracH, PingetC, CerantolaY, et al. Cost-effectiveness analysis of immune-modulating nutritional support for gastrointestinal cancer patients[J]. Clin Nutr, 2014, 33(4):649-654. DOI: 10.1016/j.clnu.2013.09.001.
[104]李卡, 郭海燕, 张静, 等. 术前使用免疫增强型肠内营养对结直肠癌病人术后营养和并发症影响的前瞻性研究[J]. 肠外与肠内营养, 2014, 21(6):329-332. DOI: 10.16151/j.1007-810x.2014.06.003.
[105]YuH, SuX, LeiT, et al. Effect of omega-3 fatty acids on chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials[J]. Int J Chron Obstruct Pulmon Dis, 2021, 16:2677-2686. DOI: 10.2147/COPD.S331154.
[106]Kristine KoekkoekW, PanteleonV, van ZantenAR. Current evidence on ω-3 fatty acids in enteral nutrition in the critically ill: a systematic review and meta-analysis[J]. Nutrition, 2019, 59:56-68. DOI: 10.1016/j.nut.2018.07.013.
[107]IbrahimES. Enteral nutrition with omega-3 fatty acids in critically ill septic patients: a randomized double-blinded study[J]. Saudi J Anaesth, 2018, 12(4):529-534. DOI: 10.4103/sja.SJA_50_18.
[108]Pontes-ArrudaA, AragãoAM, AlbuquerqueJD. Effects of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock[J]. Crit Care Med, 2006, 34(9):2325-2333. DOI: 10.1097/01.CCM.0000234033.65657.B6.
[109]刘金霞, 陈祥荣, 黄天造, 等. 含ω-3多不饱和脂肪酸肠内免疫营养支持对重型颅脑损伤机械通气患者呼吸机相关性肺炎的影响[J]. 中华临床营养杂志, 2018, 26(5):267-271. DOI: 10.3760/cma.j.issn.1674-635X.2018.05.002.
[110]吴先龙, 杨志辉, 蔡旗旗, 等. 肠内营养支持在慢性心力衰竭患者治疗中的作用[J]. 中国中西医结合急救杂志, 2019, 26(1):71-75. DOI: 10.3969/j.issn.1008-9691.2019.01.019.
[111]EliaM, EngferMB, GreenCJ, et al. Systematic review and meta-analysis: the clinical and physiological effects of fibre-containing enteral formulae[J]. Aliment Pharmacol Ther, 2008, 27(2):120-145. DOI: 10.1111/j.1365-2036.2007.03544.x.
[112]McIvorAC, MeguidMM, CurtasS, et al. Intestinal obstruction from cecal bezoar; a complication of fiber-containing tube feedings[J]. Nutrition, 1990, 6(1):115-117.
[113]ScaifeCL, SaffleJR, MorrisSE. Intestinal obstruction secondary to enteral feedings in burn trauma patients[J]. J Trauma, 1999, 47(5):859-863. DOI: 10.1097/00005373-199911000-00007.
[114]AlexanderDD, BylsmaLC, ElkayamL, et al. Nutritional and health benefits of semi-elemental diets: a comprehensive summary of the literature[J]. World J Gastrointest Pharmacol Ther, 2016, 7(2):306-319. DOI: 10.4292/wjgpt.v7.i2.306.
[115]重症患者早期肠内营养临床实践专家共识[J]. 中华危重病急救医学, 2018, 30(8):715-721. DOI: 10.3760/cma.j.issn.2095-4352.2018.08.001.
[116]EhrleinH, Haas-DeppeB. Comparison of absorption of nutrients and secretion of water between oligomeric and polymeric enteral diets in pigs[J]. Br J Nutr, 1998, 80(6):545-553. DOI: 10.1017/s0007114598001640.
[117]FerreiroB, Llopis-SalineroS, LardiesB, et al. Clinical and nutritional impact of a semi-elemental hydrolyzed whey protein diet in patients with active Crohn′s disease: a prospective observational study[J]. Nutrients, 2021, 13(10):3623. DOI: 10.3390/nu13103623.
[118]TiengouLE, GloroR, PouzouletJ, et al. Semi-elemental formula or polymeric formula: is there a better choice for enteral nutrition in acute pancreatitis? Randomized comparative study[J]. JPEN J Parenter Enteral Nutr, 2006, 30(1):1-5. DOI: 10.1177/014860710603000101.
[119]HolecekM. Branched-chain amino acids and ammonia metabolism in liver disease: therapeutic implications[J]. Nutrition, 2013, 29(10):1186-1191. DOI: 10.1016/j.nut.2013.01.022.
[120]MarchesiniG, BianchiG, MerliM, et al. Nutritional supplementation with branched-chain amino acids in advanced cirrhosis: a double-blind, randomized trial[J]. Gastroenterology, 2003, 124(7):1792-1801. DOI: 10.1016/s0016-5085(03)00323-8.
[121]MutoY, SatoS, WatanabeA, et al. Effects of oral branched-chain amino acid granules on event-free survival in patients with liver cirrhosis[J]. Clin Gastroenterol Hepatol, 2005, 3(7):705-713. DOI: 10.1016/s1542-3565(05)00017-0.
[122]CharltonM. Branched-chain amino acid enrichedsupplementsastherapy for liver disease[J]. J Nutr, 2006, 136(1Suppl):295S-298S. DOI: 10.1093/jn/136.1.295S.
[123]陈玮, 王希, 潘思旭, 等. 糖尿病专用配方和标准肠内营养制剂对重症病人高血糖影响的Meta分析[J]. 肠外与肠内营养, 2021, 28(6):368-375. DOI: 10.16151/j.1007-810x.2021.06.010.
[124]de Aguiar Pastore SilvaJ, Emilia de Souza FabreM, WaitzbergDL. Omega-3 supplements for patients in chemotherapy and/or radiotherapy: a systematic review[J]. Clin Nutr, 2015, 34(3):359-366. DOI: 10.1016/j.clnu.2014.11.005.
[125]LamCN, WattAE, IsenringEA, et al. The effect of oral omega-3 polyunsaturated fatty acid supplementation on muscle maintenance and quality of life in patients with cancer: a systematic review and meta-analysis[J]. Clin Nutr, 2021, 40(6):3815-3826. DOI: 10.1016/j.clnu.2021.04.031.
[126]ShenJ, DaiS, LiZ, et al. Effect of enteral immunonutrition in patients undergoing surgery for gastrointestinal cancer: an updated systematic review and meta-analysis[J]. Front Nutr, 2022, 9:941975. DOI: 10.3389/fnut.2022.941975.
[127]RedmanMG, WardEJ, PhillipsRS. The efficacy and safety of probiotics in people with cancer: a systematic review[J]. Ann Oncol, 2014, 25(10):1919-1929. DOI: 10.1093/annonc/mdu106.
[128]YangZ, WuQ, LiuY, et al. Effect of perioperative probiotics and synbiotics on postoperative infections after gastrointestinal surgery: a systematic review with meta-analysis[J]. JPEN J Parenter Enteral Nutr, 2017, 41(6):1051-1062. DOI: 10.1177/0148607116629670.
[129]WuXD, LiuMM, LiangX, et al. Effects of perioperative supplementation with pro-/synbiotics on clinical outcomes in surgical patients: a meta-analysis with trial sequential analysis of randomized controlled trials[J]. Clin Nutr, 2018, 37(2):505-515. DOI: 10.1016/j.clnu.2016.10.015.
[130]WangK, ZengQ, LiKX, et al. Efficacy of probiotics or synbiotics for critically ill adult patients: a systematic review and meta-analysis of randomized controlled trials[J]. Burns Trauma, 2022, 10:tkac004. DOI: 10.1093/burnst/tkac004.
[131]BesselinkMG, van SantvoortHC, BuskensE, et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial[J]. Lancet, 2008, 371(9613):651-659. DOI: 10.1016/S0140-6736(08)60207-X.
[132]WangK, McIlroyK, PlankLD, et al. Prevalence, outcomes, and management of enteral tube feeding intolerance: a retrospective cohort study in a tertiary center[J]. JPEN J Parenter Enteral Nutr, 2017, 41(6):959-967. DOI: 10.1177/0148607115627142.
[133]Reintam BlaserA, StarkopfL, DeaneAM, et al. Comparison of different definitions of feeding intolerance: a retrospective observational study[J]. Clin Nutr, 2015, 34(5):956-961. DOI: 10.1016/j.clnu.2014.10.006.
[134]ReignierJ, MercierE, Le GougeA, et al. Effect of not monitoring residual gastric volume on risk of ventilator-associated pneumonia in adults receiving mechanical ventilation and early enteral feeding: a randomized controlled trial[J]. JAMA, 2013, 309(3):249-256. DOI: 10.1001/jama.2012.196377.
[135]OzenN, TosunN, YamanelL, et al. Evaluation of the effect on patient parameters of not monitoring gastric residual volume in intensive care patients on a mechanical ventilator receiving enteral feeding: a randomized clinical trial[J]. J Crit Care, 2016, 33:137-144. DOI: 10.1016/j.jcrc.2016.01.028.
[136]PoulardF, DimetJ, Martin-LefevreL, et al. Impact of not measuring residual gastric volume in mechanically ventilated patients receiving early enteral feeding: a prospective before-after study[J]. JPEN J Parenter Enteral Nutr, 2010, 34(2):125-130. DOI: 10.1177/0148607109344745.
[137]余昆容, 李梅, 王玉娥, 等. 不常规监测胃残余量对持续肠内营养的危重症患者喂养并发症及摄入热量影响的Meta分析[J]. 中国实用护理杂志, 2019, 35(30):2395-2401. DOI: 10.3760/cma.j.issn.1672-7088.2019.30.015.
[138]WangZ, DingW, FangQ, et al. Effects of not monitoring gastric residual volume in intensive care patients: a meta-analysis[J]. Int J Nurs Stud, 2019, 91:86-93. DOI: 10.1016/j.ijnurstu.2018.11.005.
[139]PhamCH, CollierZJ, GarnerWL, et al. Measuring gastric residual volumes in critically ill burn patients-A systematic review[J]. Burns, 2019, 45(3):509-525. DOI: 10.1016/j.burns.2018.05.011.
[140]WieseAN, RogersMJ, WayM, et al. The impact of removing gastric residual volume monitoring and enteral nutrition rate titration in adults receiving mechanical ventilation[J]. Aust Crit Care, 2020, 33(2):155-161. DOI: 10.1016/j.aucc.2018.12.001.
[141]TaskinG, InalV, YamanelL. Does ultrasonographic assessment of gastric antrum correlate with gastric residual volume in critically ill patients? A prospective observational study[J]. J Clin Monit Comput, 2021, 35(4):923-929. DOI: 10.1007/s10877-021-00707-y.
[142]van der Maarel-WierinkCD, VanobbergenJN, BronkhorstEM, et al. Risk factors for aspiration pneumonia in frail older people: a systematic literature review[J]. J Am Med Dir Assoc, 2011, 12(5):344-354. DOI: 10.1016/j.jamda.2010.12.099.
[143]DoleyJ. Enteral nutrition overview[J]. Nutrients, 2022, 14(11):2180. DOI: 10.3390/nu14112180.
[144]DaviesAR, MorrisonSS, BaileyMJ, et al. A multicenter, randomized controlled trial comparing early nasojejunal with nasogastric nutrition in critical illness[J]. Crit Care Med, 2012, 40(8):2342-2348. DOI: 10.1097/CCM.0b013e318255d87e.
[145]Acosta-EscribanoJ, Fernández-VivasM, Grau CarmonaT, et al. Gastric versus transpyloric feeding in severe traumatic brain injury: a prospective, randomized trial[J]. Intensive Care Med, 2010, 36(9):1532-1539. DOI: 10.1007/s00134-010-1908-3.
[146]WhiteH, SosnowskiK, TranK, et al. A randomised controlled comparison of early post-pyloric versus early gastric feeding to meet nutritional targets in ventilated intensive care patients[J]. Crit Care, 2009, 13(6):R187. DOI: 10.1186/cc8181.
[147]HsuCW, SunSF, LinSL, et al. Duodenal versus gastric feeding in medical intensive care unit patients: a prospective, randomized, clinical study[J]. Crit Care Med, 2009, 37(6):1866-1872. DOI: 10.1097/CCM.0b013e31819ffcda.
[148]MontejoJC, GrauT, AcostaJ, et al. Multicenter, prospective, randomized, single-blind study comparing the efficacy and gastrointestinal complications of early jejunal feeding with early gastric feeding in critically ill patients[J]. Crit Care Med, 2002, 30(4):796-800. DOI: 10.1097/00003246-200204000-00013.
[149]DaviesAR, FroomesPR, FrenchCJ, et al. Randomized comparison of nasojejunal and nasogastric feeding in critically ill patients[J]. Crit Care Med, 2002, 30(3):586-590. DOI: 10.1097/00003246-200203000-00016.
[150]SteevensEC, LipscombAF, PooleGV, et al. Comparison of continuous vs intermittent nasogastric enteral feeding in trauma patients: perceptions and practice[J]. Nutr Clin Pract, 2002, 17(2):118-122. DOI: 10.1177/0115426502017002118.
[151]CioconJO, Galindo-CioconDJ, TiessenC, et al. Continuous compared with intermittent tube feeding in the elderly[J]. JPEN J Parenter Enteral Nutr, 1992, 16(6):525-528. DOI: 10.1177/0148607192016006525.
[152]NicolosiLN, del Carmen RubioM, MartinezCD, et al. Effect of oral hygiene and 0.12% chlorhexidine gluconate oral rinse in preventing ventilator-associated pneumonia after cardiovascular surgery[J]. Respir Care, 2014, 59(4):504-509. DOI: 10.4187/respcare.02666.
[153]BerganEH, TuraBR, LamasCC. Impact of improvement in preoperative oral health on nosocomial pneumonia in a group of cardiac surgery patients: a single arm prospective intervention study[J]. Intensive Care Med, 2014, 40(1):23-31. DOI: 10.1007/s00134-013-3049-y.
[154]LewisK, AlqahtaniZ, McintyreL, et al. The efficacy and safety of prokinetic agents in critically ill patients receiving enteral nutrition: a systematic review and meta-analysis of randomized trials[J]. Crit Care, 2016, 20(1):259. DOI: 10.1186/s13054-016-1441-z.
[155]LiuY, DongX, YangS, et al. Metoclopramide for preventing nosocomial pneumonia in patients fed via nasogastric tubes: a systematic review and meta-analysis of randomized controlled trials[J]. Asia Pac J Clin Nutr, 2017, 26(5):820-828. DOI: 10.6133/apjcn.102016.01.
[156]HuangKS, PanBL, LaiWA, et al. Could prokinetic agents protect long-term nasogastric tube-dependent patients from being hospitalized for pneumonia? A nationwide population-based case-crossover study[J]. PLoS One, 2021, 16(4):e0249645. DOI: 10.1371/journal.pone.0249645.
[157]ThorsonMA, BlissDZ, SavikK. Re-examination of risk factors for non-Clostridium difficile-associated diarrhoea in hospitalized patients[J]. J Adv Nurs, 2008, 62(3):354-364. DOI: 10.1111/j.1365-2648.2008.04607.x.
[158]HalmosEP. Role of fodmap content in enteral nutrition-associated diarrhea[J]. J Gastroenterol Hepatol, 2013, 28Suppl 4∶25-28. DOI: 10.1111/jgh.12272.
[159]OhkuraY, UenoM, ShindohJ, et al. Randomized controlled trial on efficacy of oligomeric formula (HINE E-GEL®) versus polymeric formula (MEIN®) enteral nutrition after esophagectomy for esophageal cancer with gastric tube reconstruction[J]. Dis Esophagus, 2019, 32(5):doy084. DOI: 10.1093/dote/doy084.
[160]Sanz-ParisA, Martinez-TruferoJ, Lambea-SorrosalJ, et al. Clinical and nutritional effectiveness of a nutritional protocol with oligomeric enteral nutrition in patients with oncology treatment-related diarrhea[J]. Nutrients, 2020, 12(5):1534. DOI: 10.3390/nu12051534.
[161]Sanz-ParisA, Martinez-TruferoJ, Lambea-SorrosalJ, et al. Impact of an oral nutritional protocol with oligomeric enteral nutrition on the quality of life of patients with oncology treatment-related diarrhea[J]. Nutrients, 2020, 13(1):84. DOI: 10.3390/nu13010084.
[162]王海波, 郭志松, 李敏, 等. 益生菌联合早期肠内营养对ICU机械通气患者感染及胃肠功能障碍的影响[J]. 中国感染控制杂志, 2019, 18(2):167-171. DOI: 10.12138/j.issn.1671-9638.20193526.
[163]肖春莲, 徐丽丹, 方梅, 等. 益生菌预防机械通气患者肠内营养相关性腹泻[J]. 护理学杂志, 2010, 25(21):50-51. DOI: 10.3870/hlxzz.2010.21.050.
[164]HeylandDK, DhaliwalR, DroverJW, et al. Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients[J]. JPEN J Parenter Enteral Nutr, 2003, 27(5):355-373. DOI: 10.1177/0148607103027005355.
[165]TianF, HeighesPT, AllingstrupMJ, et al. Early enteral nutrition provided within 24 hours of ICU admission: a meta-analysis of randomized controlled trials[J]. Crit Care Med, 2018, 46(7):1049-1056. DOI: 10.1097/CCM.0000000000003152.
[166]ManclEE, MuzevichKM. Tolerability and safety of enteral nutrition in critically ill patients receiving intravenous vasopressor therapy[J]. JPEN J Parenter Enteral Nutr, 2013, 37(5):641-651. DOI: 10.1177/0148607112470460.
[167]MarvinRG, McKinleyBA, McQuigganM, et al. Nonocclusive bowel necrosis occurring in critically ill trauma patients receiving enteral nutrition manifests no reliable clinical signs for early detection[J]. Am J Surg, 2000, 179(1):7-12. DOI: 10.1016/s0002-9610(99)00261-5.
[168]WellsDL. Provision of enteral nutrition during vasopressor therapy for hemodynamic instability: an evidence-based review[J]. Nutr Clin Pract, 2012, 27(4):521-526. DOI: 10.1177/0884533612448480.
[169]Flordelís LasierraJL, Pérez-VelaJL, Umezawa MakikadoLD, et al. Early enteral nutrition in patients with hemodynamic failure following cardiac surgery[J]. JPEN J Parenter Enteral Nutr, 2015, 39(2):154-162. DOI: 10.1177/0148607113504219.
[170]MarikPE, VasuT, HiraniA, et al. Stress ulcer prophylaxis in the new millennium: a systematic review and meta-analysis[J]. Crit Care Med, 2010, 38(11):2222-2228. DOI: 10.1097/CCM.0b013e3181f17adf.
[171]RaffT, GermannG, HartmannB. The value of early enteral nutrition in the prophylaxis of stress ulceration in the severely burned patient[J]. Burns, 1997, 23(4):313-318. DOI: 10.1016/s0305-4179(97)89875-0.
[172]HébuterneX, VanbiervlietG. Feeding the patients with upper gastrointestinal bleeding[J]. Curr Opin Clin Nutr Metab Care, 2011, 14(2):197-201. DOI: 10.1097/MCO.0b013e3283436dc5.
[173]PolkTM, SchwabCW. Metabolic and nutritional support of the enterocutaneous fistula patient: a three-phase approach[J]. World J Surg, 2012, 36(3):524-533. DOI: 10.1007/s00268-011-1315-0.
[174]KirkpatrickAW, RobertsDJ, De WaeleJ, et al. Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome[J]. Intensive Care Med, 2013, 39(7):1190-1206. DOI: 10.1007/s00134-013-2906-z.
[175]WilliamsML, NolanJP. Is enteral feeding tolerated during therapeutic hypothermia?[J]. Resuscitation, 2014, 85(11):1469-1472. DOI: 10.1016/j.resuscitation.2014.08.018.
[176]KhalidI, DoshiP, DiGiovineB. Early enteral nutrition and outcomes of critically ill patients treated with vasopressors and mechanical ventilation[J]. Am J Crit Care, 2010, 19(3):261-268. DOI: 10.4037/ajcc2010197.
[177]MentecH, DupontH, BocchettiM, et al. Upper digestive intolerance during enteral nutrition in critically ill patients: frequency, risk factors, and complications[J]. Crit Care Med, 2001, 29(10):1955-1961. DOI: 10.1097/00003246-200110000-00018.
[178]FukudaY, YamamotoK, HiraoM, et al. Prevalence of malnutrition among gastric cancer patients undergoing gastrectomy and optimal preoperative nutritional support for preventing surgical site infections[J]. Ann Surg Oncol, 2015, 22Suppl 3:S778-S785. DOI: 10.1245/s10434-015-4820-9.
[179]Von MeyenfeldtMF, MeijerinkWJ, RouflartMM, et al. Perioperative nutritional support: a randomised clinical trial[J]. Clin Nutr, 1992, 11(4):180-186. DOI: 10.1016/0261-5614(92)90026-m.
[180]SimonsenC, de HeerP, BjerreED, et al. Sarcopenia and postoperative complication risk in gastrointestinal surgical oncology: a meta-analysis[J]. Ann Surg, 2018, 268(1):58-69. DOI: 10.1097/SLA.0000000000002679.
[181]ZhangB, NajaraliZ, RuoL, et al. Effect of perioperative nutritional supplementation on postoperative complications-systematic review and meta-analysis[J]. J Gastrointest Surg, 2019, 23(8):1682-1693. DOI: 10.1007/s11605-019-04173-5.
[182]WeimannA, BragaM, CarliF, et al. ESPEN guideline: clinical nutrition in surgery[J]. Clin Nutr, 2017, 36(3):623-650. DOI: 10.1016/j.clnu.2017.02.013.
[183]WeimannA, BragaM, CarliF, et al. ESPEN practical guideline: clinical nutrition in surgery[J]. Clin Nutr, 2021, 40(7):4745-4761. DOI: 10.1016/j.clnu.2021.03.031.
[184]HughesMJ, HackneyRJ, LambPJ, et al. Prehabilitation before major abdominal surgery: a systematic review and meta-analysis[J]. World J Surg, 2019, 43(7):1661-1668. DOI: 10.1007/s00268-019-04950-y.
[185]LambertJE, HayesLD, KeeganTJ, et al. The Impact of Prehabilitation on patient outcomes in hepatobiliary, colorectal, and upper gastrointestinal cancer surgery: a prisma-accordant meta-analysis[J]. Ann Surg, 2021, 274(1):70-77. DOI: 10.1097/SLA.0000000000004527.
[186]SmedleyF, BowlingT, JamesM, et al. Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and cost of care[J]. Br J Surg, 2004, 91(8):983-990. DOI: 10.1002/bjs.4578.
[187]AvenellA, SmithTO, CurtainJP, et al. Nutritional supplementation for hip fracture aftercare in older people[J]. Cochrane Database Syst Rev, 2016, 11(11):CD001880. DOI: 10.1002/14651858.CD001880.pub6.
[188]NygrenJ. The metabolic effects of fasting and surgery[J]. Best Pract Res Clin Anaesthesiol, 2006, 20(3):429-438. DOI: 10.1016/j.bpa.2006.02.004.
[189]DilmenOK, YenturE, TunaliY, et al. Does preoperative oral carbohydrate treatment reduce the postoperative surgical stress response in lumbar disc surgery?[J]. Clin Neurol Neurosurg, 2017, 153:82-86. DOI: 10.1016/j.clineuro.2016.12.016.
[190]YuillKA, RichardsonRA, DavidsonHI, et al. The administration of an oral carbohydrate-containing fluid prior to major elective upper-gastrointestinal surgery preserves skeletal muscle mass postoperatively--a randomised clinical trial[J]. Clin Nutr, 2005, 24(1):32-37. DOI: 10.1016/j.clnu.2004.06.009.
[191]SvanfeldtM, ThorellA, HauselJ, et al. Randomized clinical trial of the effect of preoperative oral carbohydrate treatment on postoperative whole-body protein and glucose kinetics[J]. Br J Surg, 2007, 94(11):1342-1350. DOI: 10.1002/bjs.5919.
[192]于洋, 周岩冰, 刘汉成, 等. 术前口服碳水化合物对胃癌术后胰岛素抵抗影响的机制研究[J]. 中华外科杂志, 2013, 51(8):696-700. DOI: 10.3760/cma.j.issn.0529-5815.2013.08.008.
[193]Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures: an updated report by the American Society of Anesthesiologists Task Force on preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration[J]. Anesthesiology, 2017, 126(3):376-393. DOI: 10.1097/ALN.0000000000001452.
[194]SøreideE, ErikssonLI, HirlekarG, et al. Pre-operative fasting guidelines: an update[J]. Acta Anaesthesiol Scand, 2005, 49(8):1041-1047. DOI: 10.1111/j.1399-6576.2005.00781.x.
[195]GrecoM, CaprettiG, BerettaL, et al. Enhanced recovery program in colorectal surgery: a meta-analysis of randomized controlled trials[J]. World J Surg, 2014, 38(6):1531-1541. DOI: 10.1007/s00268-013-2416-8.
[196]VaradhanKK, NealKR, DejongCH, et al. The enhanced recovery after surgery (ERAS) pathway for patients undergoing major elective open colorectal surgery: a meta-analysis of randomized controlled trials[J]. Clin Nutr, 2010, 29(4):434-440. DOI: 10.1016/j.clnu.2010.01.004.
[197]BerkelmansG, FransenL, Dolmans-ZwartjesA, et al. Direct oral feeding following minimally invasive esophagectomy (nutrient Ⅱ trial): an international, multicenter, open-label randomized controlled trial[J]. Ann Surg, 2020, 271(1):41-47. DOI: 10.1097/SLA.0000000000003278.
[198]JangA, JeongO. Early postoperative oral feeding after total gastrectomy in gastric carcinoma patients: a retrospective before-after study using propensity score matching[J]. JPEN J Parenter Enteral Nutr, 2019, 43(5):649-657. DOI: 10.1002/jpen.1438.
[199]OslandE, YunusRM, KhanS, et al. Early versus traditional postoperative feeding in patients undergoing resectional gastrointestinal surgery: a meta-analysis[J]. JPEN J Parenter Enteral Nutr, 2011, 35(4):473-487. DOI: 10.1177/0148607110385698.
[200]BakerM, HallidayV, WilliamsRN, et al. A systematic review of the nutritional consequences of esophagectomy[J]. Clin Nutr, 2016, 35(5):987-994. DOI: 10.1016/j.clnu.2015.08.010.
[201]TanS, MengQ, JiangY, et al. Impact of oral nutritional supplements in post-discharge patients at nutritional risk following colorectal cancer surgery: a randomised clinical trial[J]. Clin Nutr, 2021, 40(1):47-53. DOI: 10.1016/j.clnu.2020.05.038.
[202]Hellerman ItzhakiM, SingerP. Advances in medical nutrition therapy: parenteral nutrition[J]. Nutrients, 2020, 12(3):717. DOI: 10.3390/nu12030717.
[203]KottM, HartlWH, ElkeG. Enteral vs. parenteral nutrition in septic shock: are they equivalent?[J]. Curr Opin Crit Care, 2019, 25(4):340-348. DOI: 10.1097/MCC.0000000000000618.
[204]KutsogiannisJ, AlberdaC, GramlichL, et al. Early use of supplemental parenteral nutrition in critically ill patients: results of an international multicenter observational study[J]. Crit Care Med, 2011, 39(12):2691-2699. DOI: 10.1097/CCM.0b013e3182282a83.
[205]YehDD, FuentesE, QuraishiSA, et al. Adequate nutrition may get you home: effect of caloric/protein deficits on the discharge destination of critically ill surgical patients[J]. JPEN J Parenter Enteral Nutr, 2016, 40(1):37-44. DOI: 10.1177/0148607115585142.
[206]OshimaT, HeideggerCP, PichardC. Supplemental parenteral nutrition is the key to prevent energy deficits in critically ill patients[J]. Nutr Clin Pract, 2016, 31(4):432-437. DOI: 10.1177/0884533616651754.
[207]BauerP, CharpentierC, BouchetC, et al. Parenteral with enteral nutrition in the critically ill[J]. Intensive Care Med, 2000, 26(7):893-900. DOI: 10.1007/s001340051278.
[208]AlsharifDJ, AlsharifFJ, AljuraibanGS, et al. Effect of supplemental parenteral nutrition versus enteral nutrition alone on clinical outcomes in critically ill adult patients: a systematic review and meta-analysis of randomized controlled trials[J]. Nutrients, 2020, 12(10):2968. DOI: 10.3390/nu12102968.
[209]MuscaritoliM, ArendsJ, BachmannP, et al. ESPEN practical guideline: clinical nutrition in cancer[J]. Clin Nutr, 2021, 40(5):2898-2913. DOI: 10.1016/j.clnu.2021.02.005.
[210]OblingSR, WilsonBV, PfeifferP, et al. Home parenteral nutrition increases fat free mass in patients with incurable gastrointestinal cancer. Results of a randomized controlled trial[J]. Clin Nutr, 2019, 38(1):182-190. DOI: 10.1016/j.clnu.2017.12.011.
[211]SingerP, BergerMM, Van den BergheG, et al. ESPEN guidelines on parenteral nutrition: intensive care[J]. Clin Nutr, 2009, 28(4):387-400. DOI: 10.1016/j.clnu.2009.04.024.
[212]CasaerMP, MesottenD, HermansG, et al. Early versus late parenteral nutrition in critically ill adults[J]. N Engl J Med, 2011, 365(6):506-517. DOI: 10.1056/NEJMoa1102662.
[213]BostRB, TjanDH, van ZantenAR. Timing of (supplemental) parenteral nutrition in critically ill patients: a systematic review[J]. Ann Intensive Care, 2014, 4:31. DOI: 10.1186/s13613-014-0031-y.
[214]DoigGS, SimpsonF, SweetmanEA, et al. Early parenteral nutrition in critically ill patients with short-term relative contraindications to early enteral nutrition: a randomized controlled trial[J]. JAMA, 2013, 309(20):2130-2138. DOI: 10.1001/jama.2013.5124.
[215]HarveySE, ParrottF, HarrisonDA, et al. Trial of the route of early nutritional support in critically ill adults[J]. N Engl J Med, 2014, 371(18):1673-1684. DOI: 10.1056/NEJMoa1409860.
[216]ReignierJ, Boisramé-HelmsJ, BrisardL, et al. Enteral versus parenteral early nutrition in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2)[J]. Lancet, 2018, 391(10116):133-143. DOI: 10.1016/S0140-6736(17)32146-3.
[217]
GaoX, LiuY, ZhangL, et al. Effect of early vs late supplemental parenteral nutrition in patients undergoing abdominal surgery: a randomized clinical trial[J]. JAMA Surg, 2022, 157(5):384-393. DOI: 10.1001/jamasurg.2022.0269.
[218]
中华医学会肠外肠内营养学分会. 成人补充性肠外营养中国专家共识[J]. 中华胃肠外科杂志, 2017, 20(1):9-13. DOI: 10.3760/cma.j.issn.1671-0274.2017.01.002.
[219]
SimJ, HongJ, NaEM, et al. Early supplemental parenteral nutrition is associated with reduced mortality in critically ill surgical patients with high nutritional risk[J]. Clin Nutr, 2021, 40(12):5678-5683. DOI: 10.1016/j.clnu.2021.10.008.
[220]
肠外营养临床药学共识(第二版)[J]. 今日药学, 2017, 27(5):289-303. DOI: 10.12048/j.issn.1674-229X.2017.05.001.
[221]
BoulétreauP, ChassardD, AllaouchicheB, et al. Glucose-lipid ratio is a determinant of nitrogen balance during total parenteral nutrition in critically ill patients: a prospective, randomized, multicenter blind trial with an intention-to-treat analysis[J]. Intensive Care Med, 2005, 31(10):1394-1400. DOI: 10.1007/s00134-005-2771-5.
[222]
LakananurakN, TienchaiK. Incidence and risk factors of parenteral nutrition-associated liver disease in hospitalized adults: a prospective cohort study[J]. Clin Nutr ESPEN, 2019, 34:81-86. DOI: 10.1016/j.clnesp.2019.08.009.
[223]
KoretzRL, LipmanTO, KleinS. AGA technical review on parenteral nutrition[J]. Gastroenterology, 2001, 121(4):970-1001. DOI: 10.1053/gast.2001.28031.
[224]
LiC, NiQ, PeiY, et al. Meta-analysis of the efficacy and safety of structured triglyceride lipid emulsions in parenteral nutrition therapy in China[J]. Clin Nutr, 2019, 38(4):1524-1535. DOI: 10.1016/j.clnu.2018.07.013.
[225]
PradelliL, MayerK, KlekS, et al. ω-3 fatty-acid enriched parenteral nutrition in hospitalized patients: systematic review with meta-analysis and trial sequential analysis[J]. JPEN J Parenter Enteral Nutr, 2020, 44(1):44-57. DOI: 10.1002/jpen.1672.
[226]
SingerP, BendavidI, Mesilati-StahyR, et al. Enteral and supplemental parenteral nutrition enriched with omega-3 polyunsaturated fatty acids in intensive care patients-A randomized, controlled, double-blind clinical trial[J]. Clin Nutr, 2021, 40(5):2544-2554. DOI: 10.1016/j.clnu.2021.03.034.
[227]
PradelliL, KlekS, MayerK, et al. Omega-3 fatty acid-containing parenteral nutrition in ICU patients: systematic review with meta-analysis and cost-effectiveness analysis[J]. Crit Care, 2020, 24(1):634. DOI: 10.1186/s13054-020-03356-w.
[228]
Anez-BustillosL, DaoDT, BakerMA, et al. Intravenous fat emulsion formulations for the adult and pediatric patient: understanding the differences[J]. Nutr Clin Pract, 2016, 31(5):596-609. DOI: 10.1177/0884533616662996.
[229]
DaiYJ, SunLL, LiMY, et al. Comparison of formulas based on lipid emulsions of olive oil, soybean oil, or several oils for parenteral nutrition: a systematic review and meta-analysis[J]. Adv Nutr, 2016, 7(2):279-286. DOI: 10.3945/an.114.007427.
[230]
FengY, LiC, ZhangT, et al. Parenteral nutrition including an omega-3 fatty-acid-containing lipid emulsion for intensive care patients in China: a pharmacoeconomic analysis[J]. Clinicoecon Outcomes Res, 2017, 9:547-555. DOI: 10.2147/CEOR.S139902.
[231]
WangY, JiangZM, NolanMT, et al. The impact of glutamine dipeptide-supplemented parenteral nutrition on outcomes of surgical patients: a meta-analysis of randomized clinical trials[J]. JPEN J Parenter Enteral Nutr, 2010, 34(5):521-529. DOI: 10.1177/0148607110362587.
[232]
BollhalderL, PfeilAM, TomonagaY, et al. A systematic literature review and meta-analysis of randomized clinical trials of parenteral glutamine supplementation[J]. Clin Nutr, 2013, 32(2):213-223. DOI: 10.1016/j.clnu.2012.11.003.
[233]
ApostolopoulouA, HaidichAB, KofinaK, et al. Effects of glutamine supplementation on critically ill patients: focus on efficacy and safety. An overview of systematic reviews[J]. Nutrition, 2020, 78:110960. DOI: 10.1016/j.nut.2020.110960.
[234]
HeylandDK, ElkeG, CookD, et al. Glutamine and antioxidants in the critically ill patient: a post hoc analysis of a large-scale randomized trial[J]. JPEN J Parenter Enteral Nutr, 2015, 39(4):401-409. DOI: 10.1177/0148607114529994.
[235]
TsujimotoT, ShimizuK, HataN, et al. Both high and low plasma glutamine levels predict mortality in critically ill patients[J]. Surg Today, 2017, 47(11):1331-1338. DOI: 10.1007/s00595-017-1511-0.
[236]
朱明炜, 杨桦, 陈伟, 等. 静脉用丙氨酰-谷氨酰胺双肽临床应用专家共识(2021)[J]. 中华临床营养杂志, 2021, 29(4):193-200. DOI: 10.3760/cma.j.cn115822-20210521-00113.
[237]
WeiY, MengY, LiN, et al. The effects of low-ratio n-6/n-3 PUFA on biomarkers of inflammation: a systematic review and meta-analysis[J]. Food Funct, 2021, 12(1):30-40. DOI: 10.1039/d0fo01976c.
[238]
ChenB, ZhouY, YangP, et al. Safety and efficacy of fish oil-enriched parenteral nutrition regimen on postoperative patients undergoing major abdominal surgery: a meta-analysis of randomized controlled trials[J]. JPEN J Parenter Enteral Nutr, 2010, 34(4):387-394. DOI: 10.1177/0148607110362532.
[239]
HallJW. Safety, cost, and clinical considerations for the use of premixed parenteral nutrition[J]. Nutr Clin Pract, 2015, 30(3):325-330. DOI: 10.1177/0884533615578459.
[240]
PanH, CaiS, JiJ, et al. The impact of nutritional status, nutritional risk, and nutritional treatment on clinical outcome of 2 248 hospitalized cancer patients: a multi-center, prospective cohort study in Chinese teaching hospitals[J]. Nutr Cancer, 2013, 65(1):62-70. DOI: 10.1080/01635581.2013.741752.
[241]
FlynnEA, PearsonRE, BarkerKN. Observational study of accuracy in compounding i.v. admixtures at five hospitals[J]. Am J Health Syst Pharm, 1997, 54(8):904-912. DOI: 10.1093/ajhp/54.8.904.
[242]
陈伟, 周春凌, 李海龙, 等. 肠外营养预混配方与全合一配液配方的临床应用调查[J]. 中华普通外科杂志, 2011, (9):762-765. DOI: 10.3760/cma.j.issn.1007-631X.2011.09.017.
[243]
韦军民, 许静涌. 精准营养的临床应用现状与展望[J]. 中华消化外科杂志, 2021, 20(11):1153-1157. DOI: 10.3760/cma.j.cn115610-20210927-00480.
[244]
TurpinRS, CanadaT, RosenthalV, et al. Bloodstream infections associated with parenteral nutrition preparation methods in the United States: a retrospective, large database analysis[J]. JPEN J Parenter Enteral Nutr, 2012, 36(2):169-176. DOI: 10.1177/0148607111414714.
[245]
TurpinRS, SolemC, Pontes-ArrudaA, et al. The impact of parenteral nutrition preparation on bloodstream infection risk and costs[J]. Eur J Clin Nutr, 2014, 68(8):953-958. DOI: 10.1038/ejcn.2014.34.
[246]
AlfonsoJE, BerlanaD, UklejaA, et al. Clinical, ergonomic, and economic outcomes with multichamber bags compared with (hospital) pharmacy compounded bags and multibottle systems: a systematic literature review[J]. JPEN J Parenter Enteral Nutr, 2017, 41(7):1162-1177. DOI: 10.1177/0148607116657541.
[247]
Durand-ZaleskiI, DelaunayL, LangeronO, et al. Infection risk and cost-effectiveness of commercial bags or glass bottles for total parenteral nutrition[J]. Infect Control Hosp Epidemiol, 1997, 18(3):183-188. DOI: 10.1086/647584.
[248]
YuJ, WuG, TangY, et al. Efficacy, safety, and preparation of standardized parenteral nutrition regimens: three-chamber bags vs compounded Monobags-A prospective, multicenter, randomized, single-blind clinical trial[J]. Nutr Clin Pract, 2017, 32(4):545-551. DOI: 10.1177/0884533617701883.
[249]
MihatschW, FewtrellM, GouletO, et al. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: calcium, phosphorus and magnesium[J]. Clin Nutr, 2018, 37(6Pt B):2360-2365. DOI: 10.1016/j.clnu.2018.06.950.
[250]
WhiteR. Quality parenteral nutrition: an ideal mixed bag[J]. Proc Nutr Soc, 2011, 70(3):285-292. DOI: 10.1017/S0029665111000541.
[251]
BoullataJI, GilbertK, SacksG, et al. A.S.P.E.N. clinical guidelines: parenteral nutrition ordering, order review, compounding, labeling, and dispensing[J]. JPEN J Parenter Enteral Nutr, 2014, 38(3):334-377. DOI: 10.1177/0148607114521833.
[252]
MirtalloJ, CanadaT, JohnsonD, et al. Safe practices for parenteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2004, 28(6):S39-S70. DOI: 10.1177/0148607104028006s39.
[253]
中心静脉血管通路装置安全管理专家组. 中心静脉血管通路装置安全管理专家共识(2019版)[J]. 中华外科杂志, 2020, 58(4):261-272. DOI: 10.3760/cma.j.cn112139-20191226-00638.
[254]
SantacruzE, Mateo-LoboR, RiveiroJ, et al. Infectious complications in home parenteral nutrition: a long-term study with peripherally inserted central catheters, tunneled catheters, and ports[J]. Nutrition, 2019, 58:89-93. DOI: 10.1016/j.nut.2018.06.016.
[255]
HonK, BihariS, HoltA, et al. Rate of catheter-related bloodstream infections between tunneled central venous catheters versus peripherally inserted central catheters in adult home parenteral nutrition: a meta-analysis[J]. JPEN J Parenter Enteral Nutr, 2019, 43(1):41-53. DOI: 10.1002/jpen.1421.
[256]
VersoM, AgnelliG, KamphuisenPW, et al. Risk factors for upper limb deep vein thrombosis associated with the use of central vein catheter in cancer patients[J]. Intern Emerg Med, 2008, 3(2):117-122. DOI: 10.1007/s11739-008-0125-3.
[257]
PetersenJ, DelaneyJH, BrakstadMT, et al. Silicone venous access devices positioned with their tips high in the superior vena cava are more likely to malfunction[J]. Am J Surg, 1999, 178(1):38-41. DOI: 10.1016/s0002-9610(99)00124-5.
[258]
O′GradyNP, AlexanderM, BurnsLA, et al. Guidelines for the prevention of intravascular catheter-related infections[J]. Clin Infect Dis, 2011, 52(9):e162-e193. DOI: 10.1093/cid/cir257.
[259]
KuizonD, GordonSM, DolmatchBL. Single-lumen subcutaneous ports inserted by interventional radiologists in patients undergoing chemotherapy: incidence of infection and outcome of attempted catheter salvage[J]. Arch Intern Med, 2001, 161(3):406-410. DOI: 10.1001/archinte.161.3.406.
[260]
中华医学会肠外肠内营养学分会. 成人家庭肠外营养中国专家共识[J]. 中国实用外科杂志, 2017, 37(4):406-411. DOI: 10.19538/j.cjps.issn1005-2208.2017.04.22.
[261]
SaquiO, FernandesG, AllardJP. Quality of life analysis during transition from stationary to portable infusion pump in home parenteral nutrition patients: a Canadian experience[J]. Nutr Clin Pract, 2014, 29(1):131-141. DOI: 10.1177/0884533613516129.
[262]
BoutinJ, HaganE. Patients′ preference regarding portable pumps[J]. J Intraven Nurs, 1992, 15(4):230-232.
[263]
WalkerS, BannermanH, MaN, et al. Development and validation of a screening tool for early identification of bloodstream infection in older patients-A retrospective case-control study[J]. BMC Geriatr, 2020, 20(1):6. DOI: 10.1186/s12877-019-1402-x.
[264]
LiñaresJ, Sitges-SerraA, GarauJ, et al. Pathogenesis of catheter sepsis: a prospective study with quantitative and semiquantitative cultures of catheter hub and segments[J]. J Clin Microbiol, 1985, 21(3):357-360. DOI: 10.1128/jcm.21.3.357-360.1985.
[265]
BuchmanAL, OpillaM, KwasnyM, et al. Risk factors for the development of catheter-related bloodstream infections in patients receiving home parenteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2014, 38(6):744-749. DOI: 10.1177/0148607113491783.
[266]
MunckA, MalbezinS, BlochJ, et al. Follow-up of 452 totally implantable vascular devices in cystic fibrosis patients[J]. Eur Respir J, 2004, 23(3):430-434. DOI: 10.1183/09031936.04.00052504.
[267]
Pontes-ArrudaA, Dos SantosMC, MartinsLF, et al. Influence of parenteral nutrition delivery system on the development of bloodstream infections in critically ill patients: an international, multicenter, prospective, open-label, controlled study-EPICOS study[J]. JPEN J Parenter Enteral Nutr, 2012, 36(5):574-586. DOI: 10.1177/0148607111427040.
[268]
LumanW, ShafferJL. Prevalence, outcome and associated factors of deranged liver function tests in patients on home parenteral nutrition[J]. Clin Nutr, 2002, 21(4):337-343. DOI: 10.1054/clnu.2002.0554.
[269]
MundiMS, SalonenBR, BonnesS. Home parenteral nutrition: fat emulsions and potential complications[J]. Nutr Clin Pract, 2016, 31(5):629-641. DOI: 10.1177/0884533616663635.
[270]
AhmedS, InnesJK, CalderPC. Influence of different intravenous lipid emulsions on fatty acid status and laboratory and clinical outcomes in adult patients receiving home parenteral nutrition: a systematic review[J]. Clin Nutr, 2021, 40(3):1115-1122. DOI: 10.1016/j.clnu.2020.07.014.
[271]
XuZ, LiY, WangJ, et al. Effect of omega-3 polyunsaturated fatty acids to reverse biopsy-proven parenteral nutrition-associated liver disease in adults[J]. Clin Nutr, 2012, 31(2):217-223. DOI: 10.1016/j.clnu.2011.10.001.
[272]
VermeulenMA, van StijnMF, VisserM, et al. Taurine concentrations decrease in critically ill patients with shock given enteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2016, 40(2):264-272. DOI: 10.1177/0148607114567199.
[273]
万晓. 家庭肠外营养支持治疗[J]. 外科理论与实践, 2014, 19(2):179-182. DOI: 10.3969/j.issn.1007-1096.2014.02.023.
版权归中华医学会所有。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
网址:标准与规范 https://www.yuejiaxmz.com/news/view/536565
相关内容
酒店清洁标准规范酒店清洁标准规范.pdf
最新最全的节能标准规范.doc
最新最全节能标准规范.doc
垃圾清洁程序和规范标准范本
机关办公室规范标准
清洁用工具标准规范管理规程.doc
2024建筑照明设计标准最新规范
标准规范工时测定方法.doc
学生宿舍卫生规范标准

